
【题目】在某一容积为2 L的密闭容器中,加入0.8 mol的H2和0.6 mol 的I2,在一定的条件下发生如下反应:H2(g)+I2(g) ![]() 2HI(g) ΔH<0反应中各物质的浓度随时间变化情况如图:
2HI(g) ΔH<0反应中各物质的浓度随时间变化情况如图:
(1)根据如图数据,反应开始至达到平衡时,平均速率v(HI)为________。

(2)反应达到平衡后,第8 min时:①若升高温度,化学平衡常数K________(填“增大”、“减小”或“不变”),HI浓度的变化正确的是________(用如图中a~c的编号回答)。

②若加入I2,H2浓度的变化正确的是________(用如图中d~f的编号回答)。
(3)反应达到平衡后,第8 min时,若反应容器的容积扩大一倍,请在图中画出8 min后HI浓度的变化情况。
 ______
______
【答案】0.167 mol/(L·min) 减小 c f 
【解析】
根据v=△c/△t,计算平均速率v(HI);
(2)升高温度,平衡逆向移动,生成物浓度减少;
(3)若加入I2,平衡正向移动,H2浓度减少;
(4)反应是体积不变的反应,改变压强平衡不移动,容器的容积扩大一倍,平衡物质浓度减小.
(1)平均速率v(HI)=(0.5mol/L-0)÷3min=0.167molL-1min-1,故答案为:0.167molL-1min
(2)①该反应放热,升高温度,平衡逆向移动,生成物浓度减少,化学平衡常数减小,故答案为:减小,c;
②若加入I2,平衡正向移动,H2浓度减少,故答案为:f;
(3)H2(g)+I2(g)2HI(g),反应是体积不变的反应,改变压强平衡不移动,容器的容积扩大一倍,平衡时物质浓度减小,碘化氢浓度减小一半为0.25mol/L,画出的变化图象如图: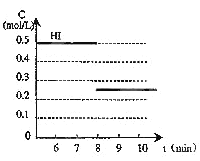 ,故答案为:
,故答案为:


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】2015年2月16日李克强总理到东北调研经济情况,重点走访了钢铁厂,鼓励钢铁厂提高钢铁质量和产量,铁及其化合物在日常生活中应用广泛。
(1)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4 H+=4Fe3++2H2O,则另一反应的离子方程式为__________;
(2)氧化铁是重要工业颜料,下面是制备氧化铁的一种方法,其流程如下:

①操作Ⅰ的名称是__________;操作Ⅱ为洗涤,洗涤操作的具体方法为__________;
②滤液A中加入稍过量的NH4HCO3溶液生成沉淀同时有一种气体产生,写出其化学方程式: __________;
(3)如果煅烧不充分,产品中将有FeO存在,称取3.0 g氧化铁产品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中,用酸化的0.01000 mol/L KMnO4溶液滴定至终点,重复滴定2-3次,消耗KMnO4溶液体积的平均值为20.00 mL,
①该实验中的KMnO4溶液需要酸化,用于酸化的酸是__________(填字母序号)。
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
②计算上述产品中Fe2O3的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 mol SO2和2 mol SO3气体混合于某固定体积的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)![]() 2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
A.2 mol SO2+1 mol O2B.4 mol SO2+1 mol O2
C.2 mol SO2+1 mol O2+2 mol SO3D.3 mol SO2+1 mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 时
时
化学式 |
|
|
|
电离平衡常数 |
|
|
|
下列说法正确的是 ( )
A. 醋酸稀释过程中,![]() 逐渐减小
逐渐减小
B. ![]() 溶液中:
溶液中:![]()
C. 向醋酸或HCN溶液中加入![]() ,均产生
,均产生![]()
D. 物质的量浓度相同时![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在当今社会,氮的氢化物和氧化物与我们的生活息息相关.
(1)NO是一种污染物,工业上用NH3、O2脱除烟气中NO的原理如图所示,该原理中NO最终转化为______(填化学式),V4+﹣O﹣H在反应过程中作___________。当消耗2molNH3和0.5molO2时,除去的NO在标准状况下的体积为____________L。
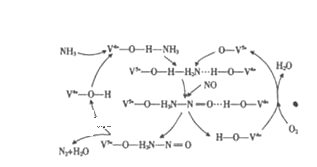
(2)N2H4是发射航天火箭的常用燃料,已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=﹣538kJ·mol﹣1。断开1mol下列化学键系数的能量分别为N﹣H:390kJ、N≡N:946kJ、O﹣H:460kJ、O=O:498kJ。则断开1molN﹣N需要吸收的能量是__________.
(3)工业制硝酸时,会发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H<0。
4NO(g)+6H2O(g) △H<0。
①若其它条件不变,则下列图象不正确的是_____(填字母)。
A. B.
B.  C.
C. D.
D.
②在1L容积固定的密闭容器中充入NH3和O2发生该反应,部分物质的浓度随时间的变化如下表所示。
| c(NH3)/mol·L﹣1 | c(O2)/mol·L﹣1 | c(NO)mol·L﹣1 |
0 | 1.2 | 1.75 | 0 |
4min | 0.4 | 0.75 | 0.8 |
6min | 0.4 | 0.75 | 0.8 |
8min | 0.6 | 1 | 0.6 |
9min | 0.6 | 1 | 0.6 |
10min | 1.05 | 1 | 1.05 |
12min | … | … | … |
0~4min内,用O2表示该反应的平均反应速率为______mol·L﹣1·min﹣1。反应6~8min时改变了反应条件,改变的反应条件可能是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体 X 和气体 Y 各 0.16mol 充入 ![]() 恒容密闭容器中,发生反应:
恒容密闭容器中,发生反应:![]()
![]() ,一段时间后达到平衡。反应过程中测定的数据如下表:
,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前 ![]() 的平均速率
的平均速率 ![]()
B.该温度下此反应的平衡常数 ![]()
C.其他条件不变,再充入 ![]() Z ,平衡时 X 的体积分数不变
Z ,平衡时 X 的体积分数不变
D.其他条件不变,降低温度,反应达到新平衡前 v(逆)> v(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。

(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择__________(填字母)。
a.碳棒b.锌板c.铜板

(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的________(填“正”或“负”)极。F电极上的电极反应式为____________________________________________________________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因_________________________________________________________________________。

(3)乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图3所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为_______________________________________________________。
②若有2mol H+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水(过氧化氢的水溶液)在工业生产和日常生活中应用广泛。
(1)双氧水常用于伤口消毒,这一过程利用了过氧化氢的_________(填过氧化氢的化学性质)。
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。已知0.4 mol液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,并放出256.652kJ的热量。该反应的热化学方程式为__________。
(3)双氧水能将碱性废水中的CN-转化成碳酸盐和一种对环境无污染的气体,CN-的电子式为________,写出该反应的离子方程式________。
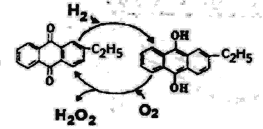
(4)下图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式_______。
(5)下图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。
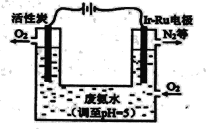
①Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式是_______。
②处理废氨水中溶质(以NH3计)的质量是34g,理论上电路中转移电子数为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是重要的资源,可以制备一系列物质。下列说法不正确的是( )
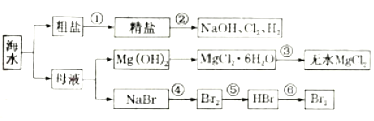
A.要除去粗盐中![]() 、
、![]() 、
、![]() 等杂质,步骤
等杂质,步骤![]() 中所加试剂及相关操作顺序可以是过量NaOH溶液
中所加试剂及相关操作顺序可以是过量NaOH溶液![]() 过量
过量![]() 溶液
溶液![]() 过量
过量![]() 溶液
溶液![]() 过滤
过滤![]() 盐酸
盐酸
B.步骤![]() 的反应原理为
的反应原理为![]()
![]()
![]()
C.步骤![]() 中需将
中需将![]() 置于干燥的HCl气流中加热脱水制备无水
置于干燥的HCl气流中加热脱水制备无水![]()
D.步骤![]() 、
、![]() 、
、![]() 所涉及的反应中,溴元素均发生氧化反应
所涉及的反应中,溴元素均发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com