

分析 ①为F-;②为Ne原子;③为Mg2+;④为Na原子;⑤为Al3+;⑥为S2-;⑦为Si原子;⑧为Fe2+;
(1)阳离子:核内质子数>核外电子数,阴离子:核内质子数<核外电子数;
(2)当原子的最外层的电子为2或8时为稳定结构;
(3)当微粒处于元素的最高价态时,此微粒只能的电子;当微粒处于元素的最低价态时,只能失电子;的那个处于中间价态时,既能失电子也能得电子;
(4)电子层数越多,半径越大;
(5)根据氧化物为R2O3来确定R的化合价,元素的最高正价=最外层电子数.
解答 解:①为F-;②为Ne原子;③为Mg2+;④为钠原子;⑤为Al3+;⑥为S2-;⑦为Si原子;⑧为Fe2+;
(1)阳离子结构:质子数>电子数,题中核内质子数>核外电子数的即为阳离子,③为Mg2+,⑤为Al3+,均为阳离子,故答案为:③⑤;
(2)原子不显电性,即质子数=电子数,故②④⑦为原子,而当原子的最外层的电子为2或8时为稳定结构,故具有稳定结构的原子为②,故答案为:②;
(3)当微粒处于元素的最高价态时,此微粒只能得电子,故只能得电子的是③⑤;当微粒处于元素的最低价态时,只能失电子,故只能失电子的是①④⑥;当处于中间价态时,既能失电子也能得电子,故既能失电子又能得电子的为⑦⑧;故答案为:③⑤;①④⑥;⑦⑧;
(4)电子层数越多,半径越大,而③Mg2+有两个电子层,④Na原子有3个电子层,故④Na原子半径更大,故答案为:小于;
(5)根据化合价规则,因为氧元素的化合价为-2,所以R元素的化合价为+3,即R原子的最外层电子数为3,故R的离子显+3价,离子的结构示意图是⑤,故答案为:⑤.
点评 本题考查学生微粒的结构示意图知识,根据结构示意图推测出微粒的种类是解题的关键,难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中所用少量氯气用如图装置制取,请回答下列问题:
实验室中所用少量氯气用如图装置制取,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
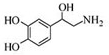
| A. | 每个去甲肾上腺素分子中含有3个酚羟基 | |
| B. | 每个去甲肾上腺素分子中含有1个手性碳原子 | |
| C. | 1mol去甲肾上腺素最多与2mol Br2发生取代反应 | |
| D. | 去甲肾上腺素既能与碳酸氢钠反应生成二氧化碳气体,又能与盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L盐酸含有NA个HCl分子 | |
| B. | 1.0 L 1.0 mol•L-1 的NaAl02水溶液中含有的氧原子数为2 NA? | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 已知C2H4和C3H6混合物的质量为ag,所含原子总数为$\frac{a{N}_{A}}{14}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
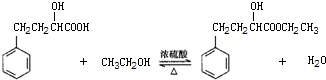
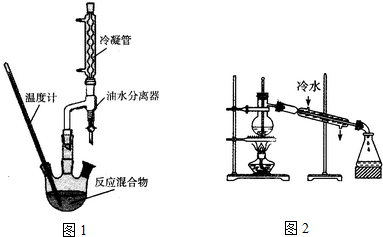
| 相对分子量 | 密度(g/cm3) | 沸点(℃) | 水溶性 | |
| 2-羟基-4-苯基丁酸 | 180 | 1.219 | 357 | 微溶 |
| 乙 醇 | 46 | 0.789 | 78.4 | 易溶 |
| 2-羟基-4-苯基丁酸乙酯 | 208 | 1.075 | 212 | 难溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com