

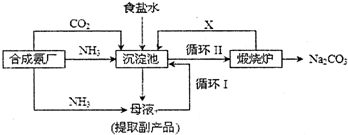
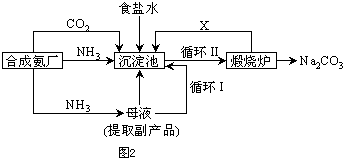
(1)上述生产纯碱的方法称__________,副产品的一种用途为____________________。
(2)沉淀池中发生的化学反应方程式是________________________________________。
(3)写出上述流程中X物质的化学式_______________________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了__________(填上述流程中的编号)的循环,从沉淀池中取出沉淀的操作是__________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加__________。
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品。通氨气的作用有__________。
①增大![]() 的浓度,使NH4Cl更多地析出
的浓度,使NH4Cl更多地析出
②使NaHCO3更多地析出
③使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
解析:(1)(2)两问题为识记性题目。(3)本问题需要在理解原理的基础上作出回答:CO2。(4)原子利用率和基本实验操作的考查,“循环操作”是提高原子利用率、解决环境污染等问题的关键思想,过滤是中学(实际是初中)就要求掌握的基本操作。(5)本问题是Cl-的检验,这是中学生常见离子的检验。(6)实际是平衡理论的具体应用。
答案:(1)联合制碱法或侯德榜制碱法 化肥或电解液或焊药等
(2)NH3+CO2+H2O+NaCl![]() NH4Cl+NaHCO3↓
NH4Cl+NaHCO3↓
或NH3+CO2+H2O![]() NH4HCO3 NH4HCO3+NaCl
NH4HCO3 NH4HCO3+NaCl![]() NaHCO3↓+NH4Cl
NaHCO3↓+NH4Cl
(3)CO2
(4)Ⅰ 过滤
(5)硝酸银溶液和稀硝酸
(6)(a)(c)


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
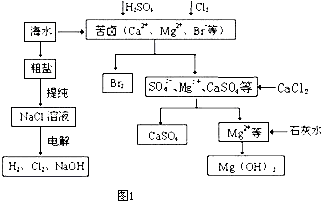
| ||
| ||
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com