
【题目】下列说法正确的是( )
A.SO2能使KMnO4水溶液迅速褪色
B.可以用澄清石灰水鉴别SO2和CO2
C.硫粉在过量的纯氧中燃烧可以生成SO3
D.SO2可用于漂白食品
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(8分)通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是(写出计算过程) 。
(2)X与金属钠反应放出氢气,反应的化学方程式是 。
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是 。
(4)X与酸性高锰酸钾溶液反应可生成Z,在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W。若184 g X和120 g Z反应能生成106 g W,计算该反应的产率(实际产量与理论产量之比) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
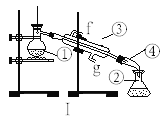
【题目】某化学课外活动小组用海带为原料制取了少量碘水。现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mLCCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗方正;
E.旋开活塞,用烧杯接收下层液体;
F.从分液漏斗口倒出上层水溶液;
G.将漏斗上口玻璃塞打开或使塞上的凹槽或小孔对准漏斗上的小孔;
H.静置、分层。
(1)上述E步骤的操作中应注意:________。
(2)上述G步骤的操作的目的是:________。
(3)能用CCl4从碘水中萃取碘的原因是_____。
(4)若利用装置I分离四氯化碳和碘的混合物,还缺少的仪器有______,将仪器补充完整后进行的实验操作的名称为:_____,仪器③和④的名称:③______④______;现需配制250ml0.2 mol/LNaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是_______ ,________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的真空密闭容器中加人1 mol CaCO3,发生反应:CaCO3(s) ![]() CaO(s)+CO2(g)。测得二氧化碳的物质的量浓度随温度的变化如图所示。图中曲线A表示CO2的平衡浓度与温度的关系;B是不同温度下,反应经过相同的时间时,CO2物质的量浓度的变化曲线.
CaO(s)+CO2(g)。测得二氧化碳的物质的量浓度随温度的变化如图所示。图中曲线A表示CO2的平衡浓度与温度的关系;B是不同温度下,反应经过相同的时间时,CO2物质的量浓度的变化曲线.

请回答下列问题:
(1)已知:①CaO(s)+SO2(g)==CaSO3(s) △H1=-402kJ·mol-1
②2CaCO3(s)+2SO2(g)+O2(g)==2CaSO4(s)+2CO2(g) △H2=-2762kJ·mol-1
③2CaSO3(s)+O2(g)==2CaSO4(s) △H3=-2315kJ·mol-1
则:CaCO3(s)==CaO(s)+CO2(g)的△H=____kJ·mol-1
(2)①温度为T5℃时,反应CaCO3(s) ![]() CaO(s)十CO2(g)耗时20s达到平衡,则20s内该反应的反应速率为v(CO2)=____;反应的平衡常数为____mol·L-1。
CaO(s)十CO2(g)耗时20s达到平衡,则20s内该反应的反应速率为v(CO2)=____;反应的平衡常数为____mol·L-1。
②如果该反应的平衡常数K值变大,该反应____(选填编号)。
A.一定向逆反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向正反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(3)在T5℃下,维持温度和容器体积不变,充入CO2气体,则达到平衡时CaCO3的质量____(填“增大”、“减小”或“不变”)。
(4)在T5℃下,反应达到平衡状态后,再压缩容器为1L,重新达到平衡时,CO2的浓度____(填“增大”、“减小”或“不变”)
(5)随着温度的升高,曲线B向曲线A逼近的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉。

(1)A与B二者反应的化学方程式为____。
(2)在上述反应中,如有1 molCl2生成,被氧化的HCl的物质的量是___,转移电子的数目是___。
(3)C中试剂是___;D中试剂的作用是___。
(4)E中现象是_____。
(5)H中试剂为_____,作用是_____。
(6)整套装置中有两处用酒精灯加热,两处酒精灯点燃的先后顺序是___、__。(用①或②填写)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有①0.112L水;②3.01×1023个氯化氢分子;③13.6 g H2S气体;④0.2 mol氨气,下列对这四种物质的关系由小到大排列正确的是( )
A. 分子数:①③②④B. 密度:④①③②
C. 质量①④③D. 氢原子数:②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个10 L的密闭容器发生反应A(g)+B(g) C(g)+D(g),测得平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | K | 0.6 | 0.4 |
回答下列问题:
(1)△H ____________ 0(填“<”或 “>”)。
(2)830℃时,向一个10 L的密闭容器中充入1mol的A和1mol的B,则:
①反应达平衡时,n (D)=0.5 mol,则A的平衡转化率为 ,
②该温度下平衡常数K= 。
(3)判断该反应是否达到平衡的依据为
a.c(A)不再改变 b.混合气体的密度不再改变
c.体系内压强不再改变 d.单位时间内生成C和消耗D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 是前四周期原子序数依次增大的五种元素。A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D 可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1。E 元素原子的K、L层电子数之和等于其M 、N 层电子数之和。请回答下列各题(涉及元素请请用相应化学符号表示):
(1)B、C、D 三种元素中电负性由大到小的排序为__________(用元素符号回答),其中D 元素基态原子的电子排布图为________________。
(2)在B的基态原子中,核外存在___________对自旋相反的电子。
(3)由E和D形成的晶胞如图1所示。晶体中E2+周围等距且最近的E2+有__________个; E 和B 可形成的晶体的晶胞结构与NaCl晶体的相似(如图2 所示),但该晶体中含有B22-的存在,晶体中E2+的配位数为__________,该化合物的电子式为______________。

(4)用高能射线照射液态H时,一个H 分子能释放出一个电子,同时产生一种阳离子。
①释放出来的电子可以被若千H 分子形成的“网”捕获。你认为H分子间能形成“网”的原因是________________。
②由H 分子释放出一个电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2 的水溶液反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)二水合草酸镓的结构如图所示,其中镓原子在周期表中的位置为__________,草酸根中碳原子的杂化方式为__________。

(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验 Fe2+的试剂,1mol CN-中含 π 键的数目为______ ,临床建议服用维生素 C 促进“亚铁”的吸收,避免生成 Fe3+,从原子结构角度来看,Fe2+易被氧化成 Fe3+的原因是___________。
(3)化合物(CH3)3N 与盐酸反应生成[(CH3) 3NH]+,该过程新生成的化学键为______(填序号)
a. 离子键 b. 配位键 c. 氢键 d. 非极性共价键
若化合物(CH3)3N 能溶于水,试解析其原因____________________。
(4)Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。试推断 Ni2+的水合离子为 __________(填“有”或“无”)色离子,依据是_____________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
(5)元素铜与镍的第二电离能分别为:ICu=1959kJ·mol-1、INi=1753kJ·mol-1,ICu>INi的原因是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com