
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a≥b时,发生的离子反应为H++OH-=H2O | |
| B. | 当5a=4b时,发生的离子反应为4NH4++H++5OH-=4NH3•H2O+H2O | |
| C. | 当a≤b≤$\frac{3}{2}$a时,发生的离子反应为(b-a)NH4++aH++bOH-=(b-a)NH3•H2O+aH2O | |
| D. | 当a/2<b<a时,溶液中Na+、NH4+与H+的物质的量之比为b:a:(a-b) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用电解熔融的氯化钠来制备金属钠 | |
| B. | 工业上用电解熔融的氯化铝来制备金属铝 | |
| C. | 工业上用电解熔融的氯化镁来制备金属镁 | |
| D. | 工业上可用一氧化碳还原赤铁矿来制得铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
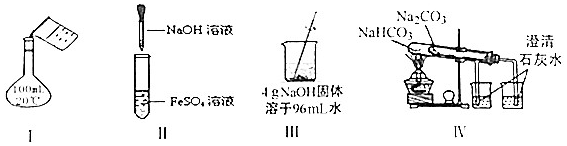
| A. | 实验Ⅰ:配制150mL0.10mol/L盐酸 | B. | 实验II:制取Fe(OH)2 | ||
| C. | 实验Ⅲ:配制4%NaOH溶液 | D. | 实验Ⅳ:比较两种物质的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molCl2常温下与过量NaOH溶液反应转移电子总数为 0.1NA | |
| B. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 0.25 mol Na2O2中含有的阴离子数为0.5 NA | |
| D. | 1L 0.1mol•L-1的硫化钠溶液中硫离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNH4+所含质子数为10 NA | |
| B. | 6.8g液态KHSO4中含有0.1NA个阳离子 | |
| C. | 常温常压下,22.4 LSO2所含的分子数为NA | |
| D. | 常温常压下,32 gO2和O3的混合气体所含原子数为 2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com