(2012?乐山二模)用菱锌矿(主要成分为碳酸锌,还含有Fe
2+、Fe
3+、Mg
2+、Ca
2+、Cu
2+等)制备氯化锌的一种流程如下:
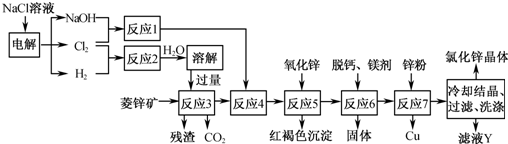
(1)在反应3前要将菱锌矿研磨,其目的是
增大反应物接触面积,使反应3反应速率加快
增大反应物接触面积,使反应3反应速率加快
.
(2)反应4将Fe
2+氧化为Fe
3+,该反应的离子方程式为
2Fe2++ClO-+2H+═2Fe3++Cl-+H2O
2Fe2++ClO-+2H+═2Fe3++Cl-+H2O
.
(3)加入氧化锌调节pH=4.5,反应5的离子方程式为
ZnO+2H+═Zn2++H2O
ZnO+2H+═Zn2++H2O
、
Fe3++3H2O?Fe(OH)3↓+3H+
Fe3++3H2O?Fe(OH)3↓+3H+
.
(4)锌粉不在反应4之前加入的原因是
Zn和H+以及Fe3+反应,将增加Zn的用量以及后续实验中次氯酸钠(或氯酸钠)的用量
Zn和H+以及Fe3+反应,将增加Zn的用量以及后续实验中次氯酸钠(或氯酸钠)的用量
.
(5)若用石墨作电极电解滤液Y,则可以得到参与本流程反应的物质有
H2、Cl2、Zn
H2、Cl2、Zn
.