
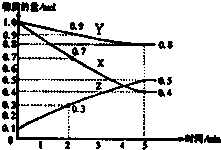
 化学反应速率与生产、生活密切相关.
化学反应速率与生产、生活密切相关.| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 50 | 120 | 232 | 288 | 310 |
| △c |
| △t |
| 0.056L |
| 22.4L/mol |
| ||
| 1min |
 2Z,故答案为:3X+Y
2Z,故答案为:3X+Y 2Z.
2Z.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
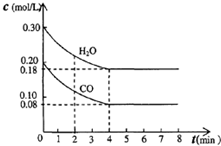 (1)氢能是高效、清洁能源,制氢技术的研究开发是氢能利用的必由之路.燃料水蒸气重整法是一种有效、经济、广泛采用的制氢方法,它是通过水蒸气与燃料间的反应来制取氢气的.①在催化剂作用下,天然气和水蒸气反应可制得一氧化碳和氢气,已知该反应每制得1kg氢气需要吸收3.44×104 kJ热量,请写出该反应的热化学式:
(1)氢能是高效、清洁能源,制氢技术的研究开发是氢能利用的必由之路.燃料水蒸气重整法是一种有效、经济、广泛采用的制氢方法,它是通过水蒸气与燃料间的反应来制取氢气的.①在催化剂作用下,天然气和水蒸气反应可制得一氧化碳和氢气,已知该反应每制得1kg氢气需要吸收3.44×104 kJ热量,请写出该反应的热化学式:查看答案和解析>>
科目:高中化学 来源: 题型:
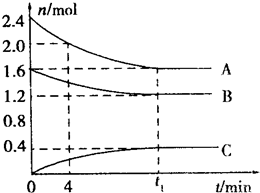 T℃时,在一容积为2L的容器中,A气体和B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示:
T℃时,在一容积为2L的容器中,A气体和B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
 该蓄电池结构和反应原理如图,其中放电时是一个
该蓄电池结构和反应原理如图,其中放电时是一个查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学合成和分离技术是人类生存所必须的,是其他各项技术的基础 |
| B、氨基酸是指分子中含有-COOH和-NH2,且连在同一个碳原子上 |
| C、根据纤维在火焰上燃烧产生的气味,确定该纤维是否为蛋白质纤维 |
| D、Na2SiO3的水溶液俗称水玻璃,用水玻璃浸泡的木材、纺织品耐火耐腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com