
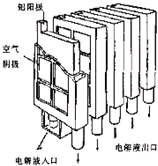
 近年来,金属-空气电池的研究和应用取得很大进步这种新型燃料电池具有比能量高、对环境友好、应用场合多等多方面优点.铝-空气电池工作原理如图所示.关于金属-空气电池的说法不正确的是( )
近年来,金属-空气电池的研究和应用取得很大进步这种新型燃料电池具有比能量高、对环境友好、应用场合多等多方面优点.铝-空气电池工作原理如图所示.关于金属-空气电池的说法不正确的是( )| A、铝-空气电池(如图)中,铝作负极,电子通过外电路到正极 |
| B、为帮助电子与空气中的氧气反应,可使用活性炭作正极材料 |
| C、碱性溶液中,负极反应为Al(s)+3OH-(aq)═Al(OH)3(s)+3e-,每消耗2.7g Al(s),需耗氧6.72L(标准状况) |
| D、金属-空气电池的可持续应用要求是一方面在工作状态下要有足够的氧气供应,另一方面在非工作状态下能够密封防止金属自腐蚀 |


科目:高中化学 来源: 题型:
| A、碱金属都可以保存在煤油中 |
| B、碱金属的金属性强弱为:Li<Na<K<Rb |
| C、随着原子序数的增加,碱金属的熔点增大 |
| D、碱金属着火应用泡沫灭火剂更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它们的氢化物的稳定性随核电荷数的增加而增强 |
| B、它们单质的氧化性依次减弱 |
| C、它们的原子核外电子层数随核电荷数的增加而增多 |
| D、单质的颜色随核电荷数的增加而加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14C和14N质量数相同,互为同位素 |
| B、12C和14N含有相同的中子数 |
| C、12C和13N中子数相同,质子数不同,互为同位素 |
| D、12CO和14CO物理性质不同,化学性质基本相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①②⑤⑥ |
| C、④⑤⑥ | D、②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
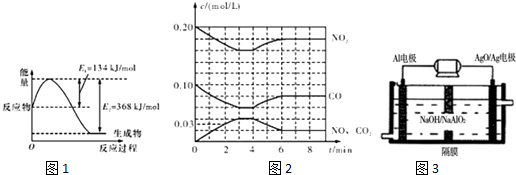
查看答案和解析>>
科目:高中化学 来源: 题型:
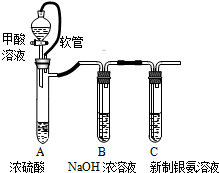 | 已知:银氨溶液制备反应为 Ag++2NH3?H2O═[Ag(NH3)2]++2H2O. 反应结束后试管C底部有黑色沉淀生成,分离出上层清液和底部黑色固体备用. |
查看答案和解析>>
科目:高中化学 来源: 题型:
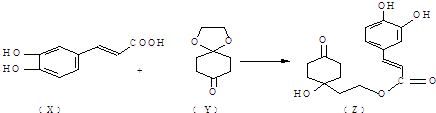
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲苯的硝化反应生成三硝基甲苯 |
| B、甲苯能使酸性高锰酸钾溶液褪色 |
| C、甲苯燃烧产生带浓烟的火焰 |
| D、1mol甲苯与3mol H2发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com