
| A. | ①④ | B. | ②③ | C. | ③④ | D. | ②⑤ |
分析 CH3COOH溶液加水稀释过程,促进电离,由于溶液的体积增大,所以c(H+)减小,Kw不变,则c(OH-)增大,以此解答该题.
解答 解:①加水稀释,溶液体积增大,c(H+)的物质的量浓度减小,故错误;
②c(H+)的物质的量浓度减小,由于c(H+)•c(OH-)不变,则c(OH-)的物质的量浓度 增大,故正确;
③加水稀释,促进醋酸的电离,溶液中n(CH3COOH)减小,n(CH3COO-)增大,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$增大,故正确;
④水为溶剂,加水稀释后,水的浓度不会变化,故错误;
⑤由于温度不变,所以水的离子积不变,即c(H+)•c(OH-)的值不会变化,故⑤错误;
故选B.
点评 本题考查了弱电解质的电离、水的离子积等,为股票开车,侧重于学生的分析能力的考查,题目难度不大,注意弱电解质浓度越小电离程度越大,侧重于考查学生的分析能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| a(干燥气体) | b(液体) | 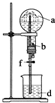 | |
| A | NO | 水 | |
| B | CO2 | 4mol•L-1NaOH溶液 | |
| C | Cl2 | 饱和NaCl溶液 | |
| D | NH3 | 热的浓的NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④<⑤<①<②<③ | B. | ⑤<④<③<②<① | C. | ①<②<④<③<⑤ | D. | ①<②<③<④<⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有少量碳酸氢钙和氯化钙的水是永久硬水 | |
| B. | 明矾有净水作用,所以用明矾处理硬水,可以使硬水软化 | |
| C. | 用离子交换剂处理硬水,只能软化暂时硬水,不能软化永久硬水 | |
| D. | 只具有暂时硬度的水经加热煮沸后,可变成软水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知常温下0.1mol•L-1NaClO溶液pH为9.7则水解方程式ClOˉ+H2O?HClO+OHˉ的平衡常数K≈10ˉ7.6 | |
| B. | 将0.2 mol•L-1的盐酸与0.1 mol•L-1的KAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(K+)<c(Cl-) | |
| C. | pH=5的HCOOH溶液和pH=5的NH4NO3溶液中,c(H+)不相等 | |
| D. | 25℃时,pH=4,浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
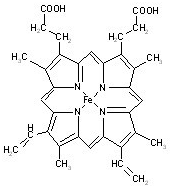 血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.
血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.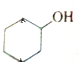 )中有3个手性碳原子.
)中有3个手性碳原子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
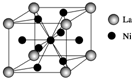 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.| I1 | I2 | I3 | I4 | I5 | |
| I/kJ•mol-1 | 738 | 1 451 | 7 733 | 10 540 | 13 630 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com