
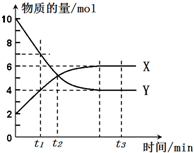
 一定温度下,在密闭容器内进行某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示.
一定温度下,在密闭容器内进行某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示.分析 (1)达到化学平衡时,Y的物质的量为4mol,变化量为10mol-4mol=6mol,X的物质的量为6mol,变化量为6mol-2mol=4mol,据此书写方程式;
(2)随着反应的进行,各组分的浓度逐渐减小,所以速率减慢;
(3)平衡状态时,一个化学反应的限度最大.
解答 解:(1)达到化学平衡时,Y的物质的量为4mol,变化量为10mol-4mol=6mol,X的物质的量为6mol,变化量为6mol-2mol=4mol,方程式为:3Y(g)═2X(g),故答案为:3Y(g)═2X(g);
(2)随着反应的进行,各组分的浓度逐渐减小,所以速率减慢,即在t1和t2时正反应速率v1>v2;故答案为:>;
(3)在t1、t2和t3三个时刻中,反应限度最大的是平衡状态时,即t3时的反应限度最大,故答案为:t3.
点评 本题考查化学平衡与图象问题的考查,侧重于学生的分析能力的考查,为高考常见题型,难度中等,注意把握图象曲线变化的趋势以及平衡状态的判断.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe-Zn合金 | B. | Fe-Cu合金 | C. | Fe-Mg合金 | D. | Mg-Al合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol/L | |
| B. | 标况下,22.4L空气中含有NA个单质分子 | |
| C. | 1molCl2参加反应转移电子数一定为2NA | |
| D. | 在18g18O2中含有10NA个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅是光导纤维的主要成分 | |
| B. | 碳酸钠是焙制糕点所用的发酵粉的主要成分之一 | |
| C. | 铝是地壳中含量最多的金属元素 | |
| D. | 在高炉炼铁工业中,炉渣成分为CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
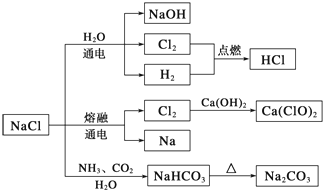
| A. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 | |
| C. | 电解NaCl溶液的阳极产物为H2和NaOH | |
| D. | 图中所示转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液的PH不变 | B. | 溶液中氢氧化钙的质量分数增大 | ||
| C. | 溶液中钙离子浓度变大 | D. | 溶液中钙离子的物质的量减少. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2HCl═CaCl2+CO2↑+H2O | B. | CaO+H2O═Ca(OH)2 | ||
| C. | 2Na2O2+2CO2═2Na2CO3+O2 | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池的负极发生氧化反应,原电池在工作时负极一定溶解 | |
| B. | 以KOH溶液为电解质溶液的甲烷燃料电池工作时,OH-离子从正极移向负极,电解质溶液的PH增大 | |
| C. | 以两个铜棒为电极电解硫酸溶液,在阴极上发生还原反应,且始终是H+在阴极放电生成H2 | |
| D. | 反应2Ag+2HCl═2AgCl+H2↑在电解的条件下可以发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | X的最高价氧化物对应水化物的酸性比W的弱 | |
| C. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| D. | W的气态简单氢化物的热稳定性比Y的强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com