
| A. | 小苏打溶液与少量澄清石灰水混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 将氯气通入水中:Cl2+H2O=Cl-+ClO-+2H+ | |
| D. | 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
分析 A.氢氧化钙少量,反应生成碳酸钙和碳酸钠和水;
B.一水合氨为弱碱,应保留化学式;
C.次氯酸为弱酸,应保留化学式;
D.硝酸根离子在酸性环境下具有强的氧化性,能够氧化二价铁离子生成三价铁离子,本身被还原为一氧化氮.
解答 解:A.小苏打溶液与少量澄清石灰水混合,离子方程式:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32-,故A错误;
B.AlCl3溶液中滴加足量氨水,反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.将氯气通入水中,离子方程式:Cl2+H2O=Cl-+HClO-+H+,故C错误;
D.向Fe(NO3)2溶液中加入稀盐酸,离子方程式:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,故D正确;
故选:D.
点评 本题考查了离子方程式书写,明确反应实质及离子方程式书写方法是解题关键,注意化学式的拆分,注意离子反应遵循客观事实,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 因铝表面能行成致密的氧化膜,所以铝制餐具可以长期使用 | |
| B. | 因废弃物易污染环境,腈纶不宜大量取代棉、麻等天然材料 | |
| C. | SiO2用途广泛,因其高熔点的特性成为光导纤维的主要原料 | |
| D. | 有机玻璃(聚甲基丙烯酸甲酯)是通过缩聚反应值得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棉花和蚕丝的主要成分都是纤维素 | |
| B. | 蛋白质在一定条件下发生水解反应生成葡萄糖 | |
| C. | 煤的气化是在高温下煤和水蒸气作用转化为可燃性气体的过程 | |
| D. | 合成材料的大量使用给人类带来了严重污染,所以要禁止生产和使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮是生命物质的重要组成元素 | |
| B. | 氮是农作物生长所必需地元素 | |
| C. | 氮的氧化物是形成酸雨的主要原因 | |
| D. | 含氮化合物不仅给人类带来福音,也给人类带来危害 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 | |
| D. | 铝箔在空气中受热可以融化,由于氧化膜的存在,融化的铝并不滴落 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
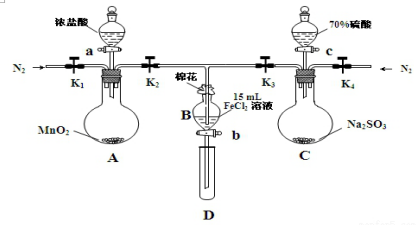
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时正极反应为:VO2++2H++e-=VO2++H2O | |
| B. | 放电时每转移2mol电子时,消耗1mol氧化剂 | |
| C. | 充电过程中电子由阳极经导线移向阴极,再由阴极经电解质溶液移向阳极 | |
| D. | 放电过程中,H+由正极移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com