
| pH | 4.13 | 5.50 | 7.00 | 8.00 | 9.00 | 10.10 | 11.20 | 13.20 |
| V(O2)/mL | 9.0 | 90 | 467 | 595 | 639 | 550 | 500 | 455 |
| 90mL |
| 60min |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 溴乙烷与氢氧化钠溶液共热后加入硝酸银溶液 | 无浅黄色沉淀出现 | 溴乙烷未水解 |
| B | 向某溶液中先滴加氯水,再滴加少量KSCN溶液 | 溶液变成血红色 | 溶液中含有Fe2+ |
| C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
| D | 向盛有碘水的试管中加入CCl4后充分振荡静置 | 液体分层,上层基本无色,下层紫红色 | 碘在CCl4中的溶解度较大 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

 ),该反应属于
),该反应属于
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 40 |
| 2 |
| 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
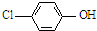 )的废水可以利用微生物电池除去,其原理如图1所示.
)的废水可以利用微生物电池除去,其原理如图1所示.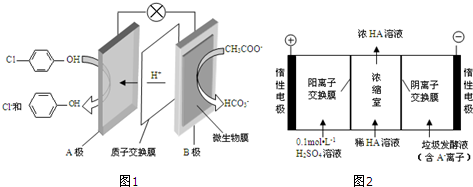
查看答案和解析>>
科目:高中化学 来源: 题型:
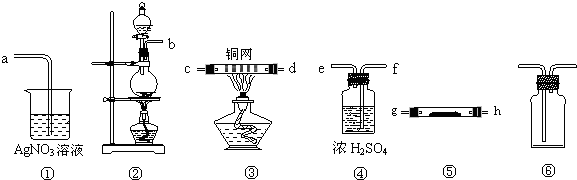
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| B | 向1mL 1%的NaOH溶液中加入2mL 2%CuSO4溶液,振荡后再加入0.5mL有机物Y,加热 | 未出现砖红色沉淀 | Y中不含有醛基 |
| C | 溴乙烷与NaOH溶液共热后,加HNO3酸化,再滴加AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷发生水解 |
| D | 向等浓度的MgCl2、CuCl2混合液中滴加氨水 | 先出现蓝色沉淀 | Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酿酒过程中,葡萄糖可通过水解反应生成酒精 |
| B、利用催化转化装置可以将汽车尾气中的NO和CO转化为无害气体 |
| C、酸性高锰酸钾溶液中加入植物油充分振荡后,溶液紫色不会褪去 |
| D、制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com