
| A、稀释溶液,水解平衡常数增大 | ||
| B、通入H2S,HS-浓度增大 | ||
C、升高温度,
| ||
| D、加入NaOH固体,溶液pH减小 |
| c(HS-) |
| c(S2-) |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
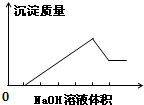 在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )| A、Mg2+、Al3+、Ba2+ |
| B、H+、Mg2+、Al3+ |
| C、H+、Cu2+、Al3+ |
| D、只有Mg2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na和O2 |
| B、NaOH和CO2 |
| C、Na2CO3和HCl |
| D、NaHCO3和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纯水在25℃和100℃时的pH |
| B、CH3COONa溶液中Na+和CH3COO-的浓度 |
| C、相同温度下,0.1 mol/LCH3COOH溶液和0.3 mol/LCH3COOH溶液的电离平衡常数 |
| D、用0.1 mol/LNaOH溶液分别中和pH、体积均相同的盐酸和醋酸,所消耗NaOH溶液的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molO的质量是32g |
| B、HCl相对分子质量36.5g/mol |
| C、SO42-的摩尔质量是96g/mol |
| D、Na的摩尔质量23 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑤ | B、①④⑤ |
| C、③④ | D、③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com