
���¶�Ϊ298Kʱ����0.10 mol��ɫ��N2O4�������1L��յ��ܱ������У����ֺ���ɫ��ֱ������N2O4(g) 2NO2(g)��ƽ�⡣��ͼ��ʾ�ⶨN2O4��Ũ����ʱ���ϵ�����ߣ�������ΪN2O4��Ũ�ȣ�������Ϊʱ�䣩��
2NO2(g)��ƽ�⡣��ͼ��ʾ�ⶨN2O4��Ũ����ʱ���ϵ�����ߣ�������ΪN2O4��Ũ�ȣ�������Ϊʱ�䣩��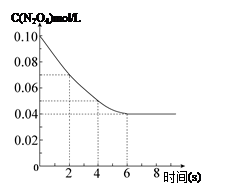
|
| T/K | 310 | 320 |
| Kֵ | 0.38 | 0.42 |

���������������1����ͼ���֪2s��4sʱ����N2O4��Ũ�ȱ仯Ϊ0.02 mol/L������v=��c/��t��Ϸ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȼ���ɵã�ע��д�嵥λ��
��2������һ�������µĿ��淴Ӧ�����۷�Ӧ������ʼ���Ǵ�����ʼ��ֻҪ�����������ʵ����൱���ͻ�ﵽͬһƽ��״̬����ͼ���֪c(N2O4)�ij�ʼŨ��Ϊ0.10mol/L��Ҫ�ﵽͬ����ƽ��״̬��������������ʼŨ����0.20mol��L-1
��3������N2O4����ʼŨ�Ⱥ�ת��Ũ�����ת���ʣ�����N2O4��NO2��ƽ��Ũ�Ⱥ�ƽ�ⳣ������ʽ��ƽ�ⳣ����
��4������һ�������µĿ��淴ӦN2O4(g) 2NO2(g)��ƽ����ٳ���0.10 mol N2O4���壬�����˷�Ӧ��Ũ��ƽ���������ƶ����ټ���N2O4��ƽ��״̬�൱������ѹǿ��ƽ�����ƣ�N2O4��ת���ʼ�С��
2NO2(g)��ƽ����ٳ���0.10 mol N2O4���壬�����˷�Ӧ��Ũ��ƽ���������ƶ����ټ���N2O4��ƽ��״̬�൱������ѹǿ��ƽ�����ƣ�N2O4��ת���ʼ�С��
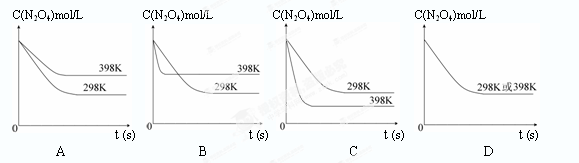
��5���ɱ������ݿ�֪���¶����ߣ�ƽ�ⳣ��������˵�������¶ȣ�ƽ��������Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ��
��6�����淴ӦN2O4(g) 2NO2(g) ����ӦΪ���ȷ�Ӧ������ƽ���������ƶ���N2O4��ƽ��Ũ�ȼ�С�����·�Ӧ���ʼӿ죬�����̴�ƽ���ʱ�䣬���ͼ��ѡC��
2NO2(g) ����ӦΪ���ȷ�Ӧ������ƽ���������ƶ���N2O4��ƽ��Ũ�ȼ�С�����·�Ӧ���ʼӿ죬�����̴�ƽ���ʱ�䣬���ͼ��ѡC��
���㣺�����˻�ѧ��Ӧ���ʵļ��㡢��ѧƽ�������ʽ����Ӧ�á�Ӱ�����صķ����жϷ�������ƽ�ⳣ���ļ���Ӧ�ü����ͼ��


 �㽭֮�ǿ�ʱ�Ż���ҵϵ�д�
�㽭֮�ǿ�ʱ�Ż���ҵϵ�д� ����˼ά�żӿ���ϵ�д�
����˼ά�żӿ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����̿�ɴ���������Ⱦ��NO��T��ʱ����1L�ܱ������м���NO�����̿�ۣ�������Ӧ������������A��B����ø����ʵ����ʵ������£�
| | ����̿/mol | NO/mol | A/mol | B/mol |
| ��ʼ״̬ | 2.030 | 0.100 | 0 | 0 |
| 2 minʱ | 2.000 | 0.040 | 0.030 | 0.030 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ��������ܱ������У��������»�ѧ��Ӧ��
Fe2O3(s)��3CO(g)  2Fe(s)��3CO2(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
2Fe(s)��3CO2(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| t�� | 1000 | 1150 | 1300 |
| K | 64.0 | 50.7 | 42.9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��
CO ( g ) + 2H2 ( g )  CH3OH ( g ) ��H=-116kJ/mol
CH3OH ( g ) ��H=-116kJ/mol
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ ��
��2�����д�ʩ������������÷�Ӧ�ķ�Ӧ���������ת���ʵ��� (����ĸ���) ��
a����ʱ��CH3OH�뷴Ӧ�������� b�����ͷ�Ӧ�¶�
c��ʹ�ø�Ч���� d��������ϵѹǿ
(3)һ�������£���1 mol CO��3 mol H2�Ļ�������ڴ��������·�����Ӧ���ɼ״���ƽ����������ݻ�ѹ����ԭ����l/2�������������䣬��ƽ����ϵ������Ӱ���� (����ĸ���)��
a��c ( H2 )���� b������Ӧ���ʼӿ죬�淴Ӧ���ʼ���
c��CH3OH �����ʵ������� d������ƽ��c ( H2 )/ c (CH3OH )��С
��4�� ���ܱ������г���1mol CO��2 mol H2���ڴ��������·�Ӧ���ɼ״���CO��ת����(��)���¶�(T)��ѹǿ(P)�Ĺ�ϵ��ͼ��ʾ��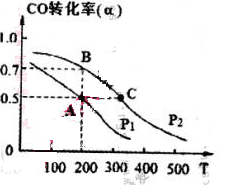
��A��C���㶼��ʾ�ﵽ��ƽ��״̬�����Է�Ӧ��ʼ����ƽ��״̬�����ʱ�䣬tA tC(����ڡ�����С�ڡ�������")��
����A��ʱ���������Ϊ1 L�����¶���B���ƽ�ⳣ�� K= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
һ�������£���Ӧ�ң��ݻ��㶨Ϊ2L�����з�Ӧ��A(g) +2B(g) C(g)
C(g)
��1����˵��������Ӧ�ﵽƽ��״̬���� ��ѡ����ĸ����
A����Ӧ��A��B�����ʵ���Ũ��֮��Ϊ1�U2
B��������������ʵ������ٱ仯
C�����������ܶȲ���ʱ��ı仯���仯
D��2������A��= ������B��
��2���÷�Ӧƽ�ⳣ��K�ı���ʽ��K= ��
��3��1molA(g)��2molB(g)�ڴ����������ڷ�Ӧ�ҷ�Ӧ����C(g)��A��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ����
��P1 P2 �� ����Ӧ�ġ�H 0���<������>����=������
�����д�ʩ��һ����ʹc(C)/c(A)������� ��ѡ���ţ���
A�������¶� B�����º����ٳ���A
C�����º����ٳ���B D�����º����ٳ���1 mol C
��4��100��ʱ��1mol A��2molBͨ�뷴Ӧ�ң������¶Ȳ��䣬10minĩC(g) ��Ũ��Ϊ0.05mol/L ����10minĩBת����= ����ʱ���� ����
���<������>����=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ������CO��ˮ������һ�������·�����Ӧ��ȡ������CO(g)+H2O(g) CO2(g)+H2(g)ij�о�С��ֱ��������Ϊ2L�ĺ����ܱ������м���һ�����ķ�Ӧ�ʹ�䷢����Ӧ������������£�
CO2(g)+H2(g)ij�о�С��ֱ��������Ϊ2L�ĺ����ܱ������м���һ�����ķ�Ӧ�ʹ�䷢����Ӧ������������£�
| ������� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ���ʱ��/min | �ﵽƽ��ʱ��ϵ�����ı仯/kJ | ||
| CO | H2O | CO2 | H2 | ||||
| �� | 650 | 1 | 2 | 0��4 | 0��4 | 5 | 16��4 |
| �� | 650 | 2 | 4 | | | t1 | Q1 |
| �� | 900 | 2 | 4 | 1��6 | 1��6 | t2 | Q2 |
 =__________��
=__________�� CO2(g)+H2(g) ��H= -41kJ/mol
CO2(g)+H2(g) ��H= -41kJ/mol�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����A(g)+B(g)  xC��g�� ��H ��:
xC��g�� ��H ��: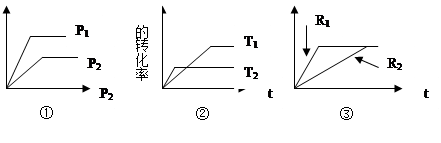
��1����ͼ����P1 P2 ,��x��ֵΪ ��
��2����ͼ����T1 T2 ���Ҧ�H 0��
��3�������ͼR1,R2�ֱ��ʾ�ı�ѹǿ����R1 R2 ,x��ֵΪ ��
��4�������ͼ�ֱ��ʾ����������R1��ʾ ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(6��)��֪��T�桢P kpaʱ���ݻ�ΪV ���ܱ������г���1molA��2molB�����ֺ��º�ѹʹ��Ӧ��ƽ�⣺A(g)+B(g) C(g)��ƽ��ʱC ���������Ϊ40�G��
C(g)��ƽ��ʱC ���������Ϊ40�G��
(1)�������¶ȡ�ѹǿ�����������²��䣬���ܱ������г���2molA��4molB����ƽ��ʱ��ϵ�ݻ�Ϊ ��C���������Ϊ ��
(2)��ȡһ���ݻ��̶�������ܱ��������Կ����¶�ΪT�棬����1molB��1molC��Ҫʹƽ��ʱC �����������Ϊ40�G������ܱ��������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ͼ��ú������ҵ����һ���֣���������ѧ֪ʶ������������⣺
��1����֪�ò�ҵ����ij��Ӧ��ƽ�ⳣ������ʽΪ��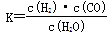 ��������Ӧ��Ӧ�Ļ�ѧ����ʽ��
��������Ӧ��Ӧ�Ļ�ѧ����ʽ��
_________________________________��
��2���ϳɼ״�����Ҫ��Ӧ�ǣ�2H2��g��+CO��g�� CH3OH��g��+90.8kJ��t���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧl0min���ø���ֵ�Ũ�����£�
CH3OH��g��+90.8kJ��t���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧl0min���ø���ֵ�Ũ�����£�
| ���� | H2 | CO | CH3OH |
| Ũ�ȣ�mol/L�� | 0.2 | 0.1 | 0.4 |
| ��Ӧ | �����̵� | ��ҵ�̵� | ||||
| �¶�/�� | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84��10-31 | 0.1 | 5��108 | 1.847 | 0.507 | 0.152 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com