
| A. | 标准状况下,0.1NA个水分子所占的体积约是2.24 L | |
| B. | 常温常压下,11.2 L CO2中含有11NA个电子 | |
| C. | CH4的摩尔质量和NA个甲烷分子的质量相等 | |
| D. | 常温下,64gSO2气体中含有的原子数为3NA |
分析 A、标况下水为液态;
B、常温常压下,气体摩尔体积大于22.4L/mol;
C、摩尔质量的单位为g/mol,质量的单位为g;
D、求出二氧化硫的物质的量,然后根据二氧化硫中含3个原子来分析.
解答 解:A、标况下水为液态,故不能根据气体摩尔体积来计算其在标况下的体积,故A错误;
B、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L二氧化碳的物质的量小于0.5mol,则含有的电子个数小于11NA个,故B错误;
C、摩尔质量的单位为g/mol,质量的单位为g,故甲烷和摩尔质量与NA个甲烷分子的质量只能是在数值上相等,故C错误;
D、64g二氧化硫的物质的量为n=$\frac{64g}{64g/mol}$=1mol,而二氧化硫中含3个原子,故1mol二氧化硫中含3mol原子即3NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+ | |
| B. | 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:Fe3+、Cu2+、Fe2+、H+ | |
| C. | 在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:Ba(OH)2、KOH、K2CO3、BaCO3 | |
| D. | 含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
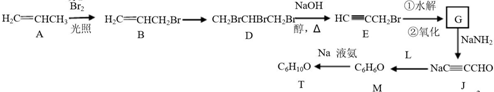
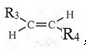 ,则T的结构简式为
,则T的结构简式为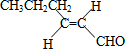 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol水蒸汽 | B. | 标准状况下1 mol CCl4 | ||
| C. | 标准状况下44 g二氧化碳 | D. | 0℃、202 kPa时2 g氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
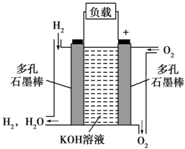 如图所示为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
如图所示为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y能形成两种常见的气态化合物 | |
| B. | 原子半径的大小顺序:r(Z)>r(R)>r(X)>r(Y) | |
| C. | X、Z分别与R形成的化合物中化学键类型不同 | |
| D. | 含有Y、Z、R三种元素的化合物最多只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 1mol•L-1NaHCO3溶液中含有HCO3-数目为NA | |
| B. | 1mol Cl2与足量的铁反应,转移的电子数为3NA | |
| C. | 标准状况下,22.4L乙醇的分子数为NA | |
| D. | 17g H2O2所含共价键的总数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
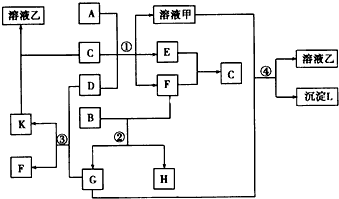
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com