
下图为向25mL 0.1 mol?L-1 NaOH溶液中逐滴滴加0.2 mol?L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:

(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,
这种看法是否正确? (选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内? 区间(若正确,此问不答)
(2)关于该滴定实验,从下列选项中选出最恰当的一项 。(选填字母)
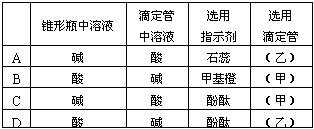

(3)AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH) 2c(Na+)。
(填“>”、“<”或“=”)
科目:高中化学 来源: 题型:
下图为常温下向25mL 0.1 mol/L MOH溶液中逐滴滴加0.2 mol/LHA溶液过程中溶液pH的变化曲线。

下列推断错误的是( )
A.M一定是碱金属元素
B.AB区间,c(OH-)>c(H+),则c(OH-)≥c(A-)
C. HA为弱酸
D. 在D点时,溶液中c(A-)+c(HA)=2c(M+)
查看答案和解析>>
科目:高中化学 来源: 题型:
现有E、F、H、I、G、K六种原子序数依次增大的前四周期主族元素,且分属四个不同周期,E、G同主族,F、H、I为同周期相邻的三种元素,其中F元素形成的化合物种类是所有元素中最多的,I、G简单离子具有相同的电子层结构,K与F形成的离子化合物Q与E和I形成的常见共价化合物R之间的反应是实验室常见的可燃气体制备原理。(题中的字母只代表元素代号,与实际元素符号无关),请回答下列问题:
(1)E~K六种元素原子,原子半径第三大的是 (填对应的元素符号,下同)。
(2)E与H两种元素组成一种阳离子,该离子的结构式为 。
(3)I、G两种元素组成含有两种化学键的化合物,该化合物的电子式为
。
(4)下图为常温下向25mL 0.1 mol·L-1 由E、I、G组成的化合物W溶液中逐滴滴加0.2 mol·L-1E、F、I组成相对分子质量为60的一元酸Z溶液过程中溶液pH的变化曲线。

①上图能确定Z为 (“强”或“弱”)酸,理由是
②B点溶液呈中性,有人据此认为,在B点时W与Z恰好完全反应,这种看法是否正确? (选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内? 区间(若正确,此问不答)。
(5)写出Q与R之间的化学反应方程式 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年黑龙江省高三12月月考(理综)化学部分 题型:实验题
I.某中和滴定实验过程如下:
(1)取一支用蒸馏水洗净的酸式滴定管,加入标准的盐酸溶液,记录初始读数
(2)用碱式滴定管放出一定量待测液,置于未用待测液润洗的锥形瓶中,加入酚酞2滴
(3)滴定时,边滴加边振荡,同时注视滴定管内液面的变化
(4)当滴到溶液由红色变为无色,颜色稳定后停止滴定,记录液面读数
请选出上述实验过程中的错误之处 (填序号)。
II.某烧碱溶液中含有少量杂质(不与盐酸反应),现用盐酸溶液测定其浓度。
(1)滴定:下图表示某次滴定时50 mL酸式滴定管中前后液面的位置,请将相关数据填入下表空格中。

|
滴定序号 |
待测液体积 (mL) |
所消耗盐酸体积(mL)(滴定前) |
所消耗盐酸体积(mL)(滴定后) |
所消耗盐酸体积(mL) |
|
1 |
25.00 |
0.50 |
25.12 |
24.62 |
|
2 |
25.00 |
|
|
|
|
3 |
25.00 |
6.00 |
30.58 |
24.58 |
(2)盐酸浓度为0.1000mol/L。根据所给数据,计算样品中烧碱的物质的量浓度c = 。
(3)下列几种情况所测烧碱浓度与实际浓度相比:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则测定结果 ;
b.酸式滴定管读数时,若滴定前仰视,滴定后俯视,则测定结果 ;
c.酸式滴定管中滴定前有气泡,滴定后气泡消失,则测定结果 ;
III.向25mL 0.1mol/L NaOH 溶液中加入25mL 0.2mol/L CH3COOH溶液,充分反应后
(pH<7),溶液中下列微粒:Na+,OH-,CH3COO-,H+,CH3COOH的浓度由大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源:0119 竞赛题 题型:填空题
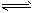 CH3COO-+H+。
CH3COO-+H+。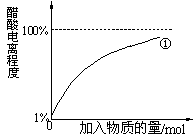

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com