
取少量Fe2O3粉末(红棕色)加 入适量盐酸,发生反应的化学方程式: ,反应后得到的溶液呈黄色.用此溶液分别做如下实验:
(1)取少量溶液置于试管中,NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为
此反应属于 .
(2)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈 色,即制得Fe(OH)3胶体
(3)取另一只小烧杯也加入20mL蒸馏水,向烧杯中加入1mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到乙烧杯中的液体产生丁达尔效应.这个实验可以用来区别胶体和溶液.
(4)取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀HI溶液,边滴加边振荡,会出现一系列变化.
①先出现红褐色沉淀,原因是 .
②随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式: .
③最后溶液颜色加深,原因是 .(用离子方程式表示).
考点: 铁的氧化物和氢氧化物;胶体的重要性质;氧化还原反应.
分析: 根据金属氧化物与酸反应生成盐和水,写出相应的化学方程式;氯化铁溶液显黄色,
(1)氧化铁与盐酸反应生成氯化铁和水,依此写出相应的化学方程式;复分解反应:是由两种化合物互相交换成分,生成另外两种化合物的反应;
(2)根据制取氢氧化铁胶体的实验分析,氢氧化铁胶体为红褐色;
(3)胶体和溶液是不同的分散系,胶体有丁达尔效应溶液没有;
(4)①依据胶体聚沉的性质解答;
②氢氧化铁与氢碘酸发生酸碱中和反应;
③三价铁离子具有强的氧化性,能够氧化碘离子.
解答: 解:Fe2O3粉末(红棕色)加入适量盐酸,所发生的反应的化学方程式为:Fe2O3 +6HCl=2FeCl3 +3H2O,所得溶液是FeCl3溶液,溶液中含有Fe3+离子,溶液呈黄色.
故答案为:Fe2O3 +6HCl=2FeCl3 +3H2O,黄;
(1)取少量此溶液,滴入NaOH溶液,发生反应:FeCl3 +3NaOH=Fe(OH)3↓+3NaCl,此反应属于复分解反应,
故答案为:FeCl3 +3NaOH=Fe(OH)3↓+3NaCl,复分解反应;
(2)向沸水中滴入几滴FeCl3饱和溶液,继续煮沸至溶液变成红褐色,即可制得氢氧化铁胶体,
故答案为:红褐;
(3)胶体具有丁达尔效应,故而溶液没有,故可以看到乙烧杯中的液体产生丁达尔效应;这个实验可以用来区别胶体和溶液;
故答案为:乙,胶体和溶液;
(4)①碘化氢为可溶性电解质,能够使氢氧化铁胶体发生聚沉,出现红褐色沉淀;
故答案为:加入电解质后,胶体发生聚沉;
②氢氧化铁与氢碘酸发生酸碱中和反应:Fe(OH)3+3H+═Fe3++3H2O,所以沉淀溶解,溶液呈黄色;
故答案为:Fe(OH)3+3H+═Fe3++3H2O;
③三价铁离子具有强的氧化性,能够氧化碘离子,生成单质碘,反应的离子方程式为:2Fe3++2I﹣═I2+2Fe2+,所以最后溶液颜色加深;
故答案为:2Fe3++2I﹣═I2+2Fe2+.
点评: 本题考查氢氧化铁胶体的制备和性质,以及相关化学方程式和离子方程式的书写,难度中等.了解胶体的制备及性质是解题关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气体通入BaCl2溶液,产生的沉淀为()
A. BaSO4 B. BaSO3 C. BaS D. BaSO4和BaSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
有一含NaCl、Na2CO3•10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数.
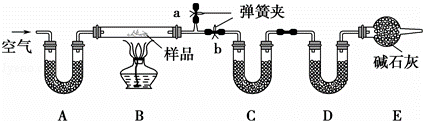
(1)加热前通入空气的目的是 ,操作方法为 .
装置A、C、D中盛放的试剂分别为:A ,C ,D .
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl的含量将 (填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将 ;若撤去E装置,则测得Na2CO3•10H2O的含量将 .
(4)若样品质量为wg,反应后C、D增加的质量分别为m1g、m2g,由此可知混合物中NaHCO3的质量分数为 % (用含w、m1、m2的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是()
A. 信息产业中的光缆的主要成份是单质硅
B. 利用激光笔可以区别鸡蛋清和浓盐水
C. 油脂、糖类、蛋白质都属于天然高分子化合物
D. 煤经气化、液化和干馏三个物理变化过程,可变为清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
对物质进行分类是为了更好地认识物质的共性.下列分类的依据及分类方法正确的是()
A. 根据物质能否溶于水,将物质分为易溶物质和难溶物质
B. 根据化学反应中是否有单质生成把化学反应分为氧化还原反应和非氧化还原反应
C. 根据物质中是否含碳元素,将物质分为无机物和有机物
D. 根据酸中是否含有氧元素,将酸分为无氧酸和含氧酸
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温下,某溶液中由水电离出的c(H+)= 1× 10﹣11 mol • L﹣1,下列说法中正确的是
| A.该溶液肯定显碱性 | B.该溶液肯定显酸性 |
| C.该溶液的pH可能是11,也可能是3 | D.该溶液的pH肯定不是11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2001年9月1日将执行国家食品卫生标准规定,酱油中3﹣氯丙醇(ClCH2CH2CH2OH)含量不得超过1ppm.相对分子质量为94.5的氯丙醇(不含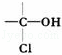 结构)共有( )
结构)共有( )
A. 5种 B. 4种 C. 3种 D. 2种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com