
 T��W��X��Y��Z��Ԫ�����ڱ�ǰ�������еij���Ԫ�أ�ԭ�������������������Ϣ���±���
T��W��X��Y��Z��Ԫ�����ڱ�ǰ�������еij���Ԫ�أ�ԭ�������������������Ϣ���±���| Ԫ�� | �����Ϣ |
| T | TԪ�ؿ��γ���Ȼ��Ӳ�����ĵ��� |
| W | W��Tͬ���ڣ�������һ��δ�ɶԵ��� |
| X | Xԭ�ӵĵ�һ�����������ĵ����ֱܷ��ǣ�I1=578kJ/mol��I2=1817kJ/mol��I3=2745kJ/molkJ/mol��I4=11575kJ/mol |
| Y | ���³�ѹ�£�Y�����ǹ��壬�����������γ��������Ҫ���� |
| Z | Z��һ��ͬλ�ص�������Ϊ63��������Ϊ34 Ni |
���� T��W��X��Y��Z��Ԫ�����ڱ�ǰ�������еij���Ԫ�أ�ԭ��������������TԪ�ؿ��γ���Ȼ��Ӳ�����ĵ��ʣ���TΪ̼Ԫ�أ�W��Tͬ���ڣ�������һ��δ�ɶԵ��ӣ�WΪ��Ԫ�أ�Xԭ�ӵĵ�һ�����������ĵ����ֱܷ��ǣ�I1=578kJ/mol��I2=1817kJ/mol��I3=2745kJ/molkJ/mol��I4=11575kJ/mol��I1��I2��I3��I4�IJ��ϴ�����Xԭ����������������ӣ�����XΪ��Ԫ�أ����³�ѹ�£�Y�����ǹ��壬�����������γ��������Ҫ���ʣ�����YΪ��Ԫ�أ�Z��һ��ͬλ�ص�������Ϊ63��������Ϊ34��ͬZ��������Ϊ29������ZΪͭԪ�أ��ݴ˴��⣮
��� �⣺T��W��X��Y��Z��Ԫ�����ڱ�ǰ�������еij���Ԫ�أ�ԭ��������������TԪ�ؿ��γ���Ȼ��Ӳ�����ĵ��ʣ���TΪ̼Ԫ�أ�W��Tͬ���ڣ�������һ��δ�ɶԵ��ӣ�WΪ��Ԫ�أ�Xԭ�ӵĵ�һ�����������ĵ����ֱܷ��ǣ�I1=578kJ/mol��I2=1817kJ/mol��I3=2745kJ/molkJ/mol��I4=11575kJ/mol��I1��I2��I3��I4�IJ��ϴ�����Xԭ����������������ӣ�����XΪ��Ԫ�أ����³�ѹ�£�Y�����ǹ��壬�����������γ��������Ҫ���ʣ�����YΪ��Ԫ�أ�Z��һ��ͬλ�ص�������Ϊ63��������Ϊ34��ͬZ��������Ϊ29������ZΪͭԪ�أ�
��1��CS2�д�����̼��˫����̼ԭ��û�йµ��Ӷԣ�����CS2�ǷǼ��Է��ӣ������д���2���� ����WΪ��Ԫ�أ����ڷ��������֮���������������Է���������Һ����
�ʴ�Ϊ���Ǽ��Է��ӣ�2�����������֮������������
��2��13.5g��Al�����ʵ���Ϊ$\frac{13.5g}{27g/mol}$=0.5mol��4molAl��O2��������ȫȼ�պ�ָ���ԭ״̬�ų�������Ϊ419kJ��$\frac{4mol}{0.5mol}$=3352kJ�����Ȼ�ѧ����ʽΪ��4Al��s��+3 O2��g��=2Al2O3��s����H=-3352kJ/mol��
�ʴ�Ϊ��4Al��s��+3 O2��g��=2Al2O3��s����H=-3352kJ/mol��
��3��YΪ��Ԫ�أ���̬Yԭ���У��������������Ӳ㣬����ռ�ݵ�����ܲ������M��M�ܲ����spd�����ܼ���s����һ�������p�������������d����5��ԭ�ӹ�������Թ���9������ԭ�ӵ�����������Ϊ6��S��0��FԪ�صĵ�һ�������ɴ�С˳��Ϊ F��O��S��
�ʴ�Ϊ��M��9�� 6�� F��O��S��
��4��ZΪͭԪ�أ�����ͭ�ľ����ṹͼ��֪��ÿ�������к���ͭԭ����Ϊ$8��\frac{1}{8}+6��\frac{1}{2}$=4�����Ծ��������Ϊ$\frac{\frac{4��64}{{N}_{A}}}{9.00}$cm3=4.72��10-23 cm3�����Ծ����ı߳�Ϊ$\root{3}{4.72��10{\;}^{-23}}$=3.61��10-8cm��SO42-�У���ԭ�ӵļ۲���Ӷ���Ϊ$\frac{6+2}{2}$=4����ԭ��û�йµ��Ӷԣ����Կռ乹��Ϊ�������壬Sԭ�ӵ��ӻ����������sp3�ӻ����ڷ�ӦCu+HCl+O2=CuCl+HO2�У�
A��O2������������A��ȷ��
B��HO2�ǻ�ԭ�����B����
C��HO2 �������ᣩ��һ�����ᣬ����HO2�ڼ��������ȶ����ڣ���C����
D��1mol Cu�μӷ�Ӧ����������ͭ������1mol���ӷ���ת�ƣ���D��ȷ��
�ʴ�Ϊ��AD��
�ʴ�Ϊ��3.61��10-8cm���������壻sp3��AD��
���� ������Ҫ������Ԫ�����ڱ���Ԫ�������ɡ�������ԭ��Ӧ���Ȼ�ѧ����ʽ��֪ʶ�㣬�е��Ѷȣ�����Ĺؼ���Ԫ���ƶϣ�����ʱע�⻯ѧ�������ȷ���


 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 22 mL��12 mL | B�� | 13 mL��21 mL | C�� | 16 mL��16 mL | D�� | 21 mL��13 mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڢ� | B�� | �ڢܢ� | C�� | �ڢ� | D�� | �ۢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ѧΣ��Ʒ������ը�¹ʺ���ԱӦ�����Ϸ緽���� | |
| B�� | ��������Ĺ�ҵ��ˮ�����ᱵ���������ŷ������ڼ���ˮ����Ⱦ | |
| C�� | �þ۱���ϩ�������ϩ��ʳƷ��װ�����ɽ�Լ�ɱ������Dz��������彡���ͻ��� | |
| D�� | ���ı������ij���˵������ʵʩ��·���к���Ⱦ��ҵͣ���ȴ�ʩ��������Ч�ؼ��������ͱ�֤�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Mg2+��Cl-��Na+��NO3- | B�� | K+��Na+��NO3-��HCO3- | ||
| C�� | Na+��K+��Cl-��NO3- | D�� | Na+��Cl-��AlO2-��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.15 mol/L | B�� | 0.3 mol/L | C�� | 0.45 mol/L | D�� | 0.2 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
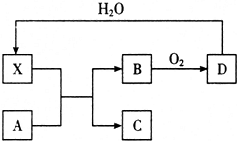 ��֪XΪһ�ֳ������Ũ��Һ����ʹ���DZ�ڣ�A��X��Ӧ��ת����ϵ��ͼ��ʾ�����з�Ӧ���������ֲ�������ȥ�������й�˵����ȷ���ǣ�������
��֪XΪһ�ֳ������Ũ��Һ����ʹ���DZ�ڣ�A��X��Ӧ��ת����ϵ��ͼ��ʾ�����з�Ӧ���������ֲ�������ȥ�������й�˵����ȷ���ǣ�������| A�� | X��ʹ���DZ����Ҫ������ X��ǿ������ | |
| B�� | ��AΪ����������A��X�������¼�����ȫ��Ӧ | |
| C�� | ��AΪ̼���ʣ���Cͨ����������ʯ��ˮ�У�����һ���а�ɫ�������� | |
| D�� | ��ҵ�ϣ�Bת��ΪD�ķ�Ӧ��ʹ�ô��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
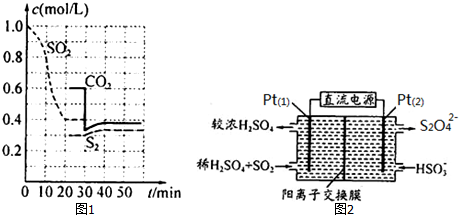
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com