
| A. | 0.5mol/L | B. | 0.75 mol/L | C. | 1 mol/L | D. | 0.25 mol/L |
分析 n(Fe3+)=$\frac{5.6g}{56g/mol}$=0.1mol,由Fe2(SO4)3可知,n(SO42-)=0.1mol×$\frac{3}{2}$=0.15mol,结合c=$\frac{n}{V}$计算.
解答 解:n(Fe3+)=$\frac{5.6g}{56g/mol}$=0.1mol,由Fe2(SO4)3可知,n(SO42-)=0.1mol×$\frac{3}{2}$=0.15mol,则溶液中SO42-的物质的量浓度是$\frac{0.15mol}{0.2L}$=0.75 mol/L,
故选B.
点评 本题考查物质的量浓度的计算,为高频考点,把握物质的量浓度、物质的量的关系及物质构成为解答的关键,侧重分析与计算能力的考查,注意硫酸根离子物质的量计算,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 已知H2(g)+Cl2(g)═2HCl(g)△H=-185kJ/mol,则氢气的燃烧热为185 kJ/mol | |
| B. | 已知石墨比金刚石稳定,则C (石墨,s)═C(金刚石,s)△H<0 | |
| C. | 已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 | |
| D. | 已知Ni(CO)4(s)═Ni(s)+4CO(g)△H=+Q kJ•mol-1,则Ni(s)+4CO(g)═Ni(CO)4(s)△H=-Q kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应CH4(g)═C(s)+2 H2(g)的△H4=+74.8kJ•mol-1 | |
| B. | 反应①中电能转化为化学能 | |
| C. | 反应②中反应物的总能量高于生成物的总能量 | |
| D. | 反应③使用催化剂,△H3减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g乙醇中存在的共价键总数为7NA | |
| B. | 1L 0.1mol•L-1的NaHCO3-溶液中HCO3-离子数为0.1NA | |
| C. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA | |
| D. | 235g核互${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n净产生的中子(${\;}_{0}^{1}$n)数为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 环氧乙烷的结构简式:C2H4O | B. | 中子数为16的磷原子:${\;}_{15}^{16}$P | ||
| C. | 氯原子的结构示意图: | D. | PC13的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
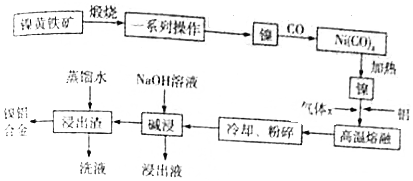
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com