
| A、玻璃钢是一种复合材料,由基体和增强体组成,基体起骨架作用 |
| B、SO2溶于水,其水溶液能导电,说明SO2是电解质 |
| C、食醋、纯碱、食盐分别属于酸、碱、盐 |
| D、生铁、不锈钢、青铜都属于合金 |


科目:高中化学 来源: 题型:
| A、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
| B、葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
| C、淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| D、纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碘化铵和氯化铵受热分解过程中破坏和形成的化学键类型完全相同 |
| B、反应N2H4(l)=N2(g)+2H2(g)是一个△S>0的反应 |
| C、1 mol FeCl3完全水解得到的Fe(OH)3胶体中胶粒数目为NA(NA为阿伏加德罗常数) |
| D、HClO是弱酸,所以NaClO是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 按要求对图中两极进行必要的联接并填空:
按要求对图中两极进行必要的联接并填空:查看答案和解析>>
科目:高中化学 来源: 题型:
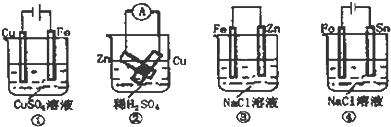
| A、按图①连接并放置一段时间后,Fe片表面会“镀”上一层铜 |
| B、按图②连接好导线后(Zn片与Cu片相接触),灵敏电流表会发生非常明显的偏转 |
| C、按图③连接并放置片刻,在Fe片附近加一滴KSCN溶液,溶液变为深红色 |
| D、按图④连接并放置一段时间后,在Sn片上有无色气泡聚集 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、88.0g 干冰中含有的电子数为8.0NA |
| B、常温下,11.2 L 乙烯在氧气中完全燃烧转移的电子数为6.0NA |
| C、常温下1.0 L 0.1 mol?L-1NH4Cl 溶液中,NH4+和H+总数大于0.1NA |
| D、1.2g 金刚石中含有的碳碳键数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
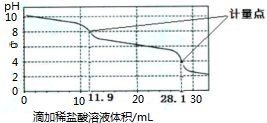
| A、上一个计量点前发生反应的离子方程式为HCO3-+H+═H2O+CO2↑ |
| B、下一个计量点溶液中存在大量的阴离子是Cl-、HCO3- |
| C、此样品n(NaHCO3)=(28.1-2×11.9)×10-3 mol |
| D、使用该方法测定Na2CO3和NaOH混合溶液中的氢氧化钠含量,将会得到1个计量点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com