
用惰性电极电解某金属元素R的硝酸盐R(NO3)n溶液,通电一段时间后,阳极产生气体V L(标准状况)时,阴极质量增加m g,若R的相对原子质量为M,设NA 为阿伏加德罗常数的值,下列叙述中不正确的是
A.电路中通过电子 NA B.n =
NA B.n = 
C.溶液中H+增加 NA D.n =
NA D.n = 
B
【解析】
试题分析:某金属元素R的硝酸盐R(NO3)n溶液,电解时由于放电能力OH-> NO3-,所以在阳极发生反应:4 OH--4e-=2H2O+O2↑,在阴极发生反应:Rn++ne-=R。A.在整个闭合回路中电子转移数目就是产生氧气时失去的电子数目,所以电路中通过电子(V÷22.4)×4NA=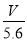 NA 。正确。B.根据电子得失数目相等可得(m÷M)×n=
NA 。正确。B.根据电子得失数目相等可得(m÷M)×n= ,所以n=
,所以n= 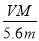 .错误。C.每转移电子1mol,就有1mol的OH-放电,同时得到1mol的H+,即溶液中的H+的物质的量增加1mol. 电路中通过电子
.错误。C.每转移电子1mol,就有1mol的OH-放电,同时得到1mol的H+,即溶液中的H+的物质的量增加1mol. 电路中通过电子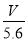 NA,所以溶液中H+增加
NA,所以溶液中H+增加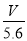 NA。正确。D.电子转移的物质的量
NA。正确。D.电子转移的物质的量 =(m÷M)n,整理可得n=
=(m÷M)n,整理可得n=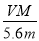 .正确。
.正确。
考点:考查电极产物及转移电子的物质的量的关系的知识。


科目:高中化学 来源:2013-2014北京市东城区高三第二学期综合练习二理综化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.布朗运动就是液体分子的热运动
B.对一定质量的气体加热,其内能一定增加.
C.物体的温度越高,分子热运动越剧烈,分子的平均动能越大
D.分子间的引力与斥力同时存在,斥力总是小于引力
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古赤峰市高三下学期4月统一考试理综化学试卷(解析版) 题型:填空题
[化学—选修2:化学与技术](15分)
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到硫酸,如橡胶的硫化、表面活性剂“烷基苯硫酸钠”的合成,铅蓄电池的生产等。工业上生产硫酸的流程图如下:


请回答下列问题
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,已知1g 完全燃烧放出7.2kJ的热量
完全燃烧放出7.2kJ的热量 燃烧反应的热化学方程式_______ ______。
燃烧反应的热化学方程式_______ ______。
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用在具有多层催化剂且又热交换的________(填仪器名称)中进行反应。在如图Ⅰ所示的装置中, A处气体进入装置前需净化的原因是 。
(3)精制炉气(含有 体积分数为7%、O2为11%、N2为82%)中
体积分数为7%、O2为11%、N2为82%)中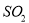 平衡 转化率与温度及压强关系如图2所示、在实际生产中,
平衡 转化率与温度及压强关系如图2所示、在实际生产中,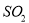 催化氧化反应的条件选择常压、
催化氧化反应的条件选择常压、 左右(对应图中A点):而没有选择
左右(对应图中A点):而没有选择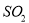 转化率更高的B或C点对应的反应条件,其原因分别是: 、 。
转化率更高的B或C点对应的反应条件,其原因分别是: 、 。

(4)已知:焙烧明矾的化学方程式4KAl(SO4)2?12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O。
焙烧711t明矾(M=474g/mol),若 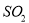 的利用率为95%,可生产质量分数为98%的硫酸 t。(结果保留小数点后一位)
的利用率为95%,可生产质量分数为98%的硫酸 t。(结果保留小数点后一位)
(5)除硫酸工业外,还有许多工业生产。下列相关的工业生产流程中正确的是
A.向装置中通入氮气且保持体积不变
B.向装置中通入氧气且保持体积不变
C.添加更多的催化剂
D.降低温度,及时转移SO3
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古赤峰市年宁城县高三5月模拟考试理综化学试卷(解析版) 题型:选择题
下表是元素周期表的一部分,X、Y、Z、W均为短周期元素,下列说法不正确的是( )
| X |
| Y |
Z |
| W |
|
A.原子半径:Z>W>X
B.若Z的最高价氧化物与Y的气态氢化物溶液混合后有气体放出,则W的气态氢化物不稳定
C.若Y、W的质子数之和为23,则Z能形成碱性氧化物
D.若X能形成两种常见的液态化合物,则W单质溶于水形成的溶液有漂白性
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省红河州高三下学期毕业生复习统一检测理综化学试卷(解析版) 题型:填空题
(15分)已知:A、B、C、D、E、F六种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中最高;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。
回答下列问题:
(1)F的原子的M层电子排布式为 。
(2)B、C、D的第一电离能由小到大的顺序为 。(用元素符号表示)
(3)A的简单氢化物分子极易溶于水,其主要原因是 .
(4)E的最高价氧化物分子的空间构型是 。其中心原子的杂化方式为 。
(5)F的高价离子与A的简单氢化物形成的配离子,配位数为 。
(6)A、F形成某种化合物的晶胞结构如图所示, 则其化学式为 ;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为 g/cm3。
则其化学式为 ;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为 g/cm3。
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省红河州高三下学期毕业生复习统一检测理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.硝基苯的结构简式为
B.表示甲烷分子或四氯化碳分子的比例模型
C.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
D.结构片段为 的高聚物,其单体是甲醛和苯酚
的高聚物,其单体是甲醛和苯酚
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:选择题
下列说法中错误的是
A.当中心原子的配位数为6时,配合单元常呈八面体空间结构
B.SO3为平面正三角形结构
C.已知[Cu (NH3)2]2+的中心原子采用sp杂化,则它们的空间构型为直线型
D.配位数为4的配合物均为正四面体结构
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:选择题
下列各组物质状态发生变化时,所克服的微粒间作用力完全相同的是
A.碘的升华和干冰气化 B.二氧化硅和干冰熔化
C.苯和硝酸钾熔化 D.食盐的熔化和冰的融化
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高一下学期期末考试化学试卷(解析版) 题型:选择题
对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是①升高温度;②改用100mL 3mol/L盐酸;③改用300mL 1mol/L盐酸;④用等量锌粉代替锌粒;⑤滴入少量CuSO4溶液
A.①②④⑤ B.①③④⑤ C.①②③④ D.①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com