
分析 (Ⅰ)(1)依据配制溶液体积选择容量瓶规格,依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积;依据配制一定物质的量浓度溶液一般步骤选择需要仪器;
(2)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(Ⅱ)碳酸钙与醋酸反应生成醋酸钙和二氧化碳和水;鸡蛋壳的内膜是半透膜,可通过渗析来分离淀粉溶液和食盐溶液,要获得较纯净的淀粉溶液需要多次操作,即反复水洗;
(Ⅲ)氯酸钾分解生成氧气和氯化钾;根据可溶性的氯化物能与反应生成不溶于硝酸的白色沉淀的性质设计实验证明氯元素的存在,据此排序.
解答 解:(Ⅰ)(1)配制230mL溶液,应选择250mL规格容量瓶,实际配制250mL溶液,浓硫酸的物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积为V,依据溶液稀释过程中溶质的物质的量不变得:V×18.4mol/L=2mol/L×250mL,解得V=27.2mL;用浓硫酸配制一定物质的量浓度稀硫酸溶液,一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶等,用到的仪器:量筒、胶头滴管、烧杯、玻璃棒、容量瓶;配制制230mL 2mol•L-1的稀硫酸,应选择520mL容量瓶,所以还缺少的仪器:250mL容量瓶、玻璃棒;
故答案为:27.2 250mL容量瓶、玻璃棒;
(2)A.容量瓶洗涤后未干燥,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故不选;
B.移液时,有少量溶液溅出,导致溶质的物质的量偏小,溶液浓度偏低,故B选;
C.定容时,加水不慎超过刻度线,又倒出一些,导致溶质的物质的量偏小,溶液浓度偏低,故C选;
D.量取溶液时,仰视刻度线,导致浓硫酸体积偏大,溶质的物质的量偏大,溶液浓度偏高,故D不选;
E.装入试剂瓶时,有少量溶液溅出,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故E不选;
故选:BC;
(Ⅱ)碳酸钙与醋酸反应生成醋酸钙和二氧化碳和水,方程式:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑;鸡蛋壳的内膜是半透膜,可通过渗析来分离淀粉溶液和食盐溶液,要获得较纯净的淀粉溶液需要多次操作,即反复水洗;
故答案为:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑;多次更换蒸馏水浸泡半透膜袋,检验蒸馏水中最终是否含有Cl-;
(Ⅲ):氯酸钾中加入二氧化锰做催化剂,将混合物加热,分解生成氧气和氯化钾,氯化钾溶于水,加水过滤;然后向剩余固体中加入硝酸银溶液和几滴稀硝酸,如产生白色沉淀,则证明氯化钾中含有氯元素,当然可推断氯酸钾中也有氯元素,所有正确的顺序为:GDFEC;
故答案为:GDFEC.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
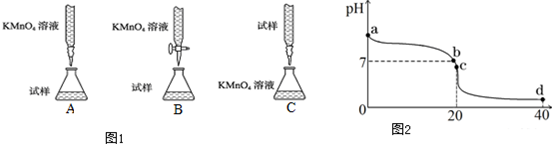
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时铁电极的质量减少11.2g.请回答 下列问题.
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时铁电极的质量减少11.2g.请回答 下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 等体积、等物质的量浓度的氨水与盐酸混合 | |
| B. | 常温下,pH=8的氨水与pH=6的硝酸等体积混合 | |
| C. | 常温下,pH=12的Ba(OH)2溶液与pH=2的NaHSO4溶液等体积混合 | |
| D. | c(H+)=c(OH-)=10-6 mol•L-1的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
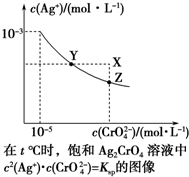 已知t℃时AgCl的Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )
已知t℃时AgCl的Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )| A. | 在t℃时,Ag2CrO4的Ksp为1×10-11 | |
| B. | 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点 | |
| C. | 在t℃,Ag2CrO4(s)+2Cl-(aq)?2AgCl(s)+CrO${\;}_{4}^{2-}$(aq)平衡常数K=6.25×107 | |
| D. | 在t℃时,以0.001 mol•L-1 AgNO3溶液滴定20 mL 0.001 mol•L-1 KCl和0.001 mol•L-1的K2CrO4的混合溶液,CrO${\;}_{4}^{2-}$先沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1-溴丙烷常用作有机反应的溶剂.实验室制备1-溴丙烷(CH3CH2CH2Br)的反应和主要实验装置如下:
1-溴丙烷常用作有机反应的溶剂.实验室制备1-溴丙烷(CH3CH2CH2Br)的反应和主要实验装置如下:| 相对分 子质量 | 密度 /g•mL-1 | 沸点/℃ | 水中 溶解性 | |
| 正丙醇 | 60 | 0.896 | 97.1 | 溶 |
| 正丙醚 | 102 | 0.74 | 90 | 几乎不溶 |
| 1-溴丙烷 | 123 | 1.36 | 71 | 不溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com