
下面是以环戊烷为原料制备环戊二烯的合成路线:
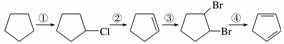
其中,反应①的产物名称是__________,反应②的反应试剂和反应条件是______________,反应③的反应类型是______________。
科目:高中化学 来源: 题型:
锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族。
(1)碱性:Sr(OH)2____Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是______________。
(2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入浓硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3。
已知:ⅰ.相同温度时的溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 |
①Ⅰ中,反应的化学方程式是_________________________________________。
②Ⅱ中,能与盐酸反应溶解的物质有_________________________________。
③Ⅳ的目的是_________________________________________________________。
④下列关于该工艺流程的说法正确的是________(填字母)。
a.该工艺产生的废液含较多的NH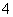 、Na+、Cl-、SO
、Na+、Cl-、SO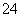
b.Ⅴ中反应时,升高温度一定可以提高SrCO3的生成速率
c.Ⅴ中反应时,加入溶液一定可以提高NH4HCO3的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
将充有n mL NO和m mL NO2气体的试管倒立于盛水的水槽中,然后通入n mL O2。m>n,则充分反应后,试管中气体在同温同压下的体积为 ( )
A.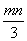 mL B.
mL B.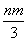 mL C.
mL C.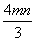 mL D.
mL D.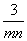 mL
mL
查看答案和解析>>
科目:高中化学 来源: 题型:
对三联苯是一种有机合成中间体,工业上合成对三联苯的化学方程式为
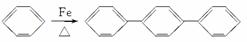 +2H2↑。下列说法不正确的是( )
+2H2↑。下列说法不正确的是( )
A.上述反应属于取代反应
B.对三联苯分子中至少有16个原子共平面
C.对三联苯的一氯取代物有4种
D.0.2 mol对三联苯在足量的氧气中完全燃烧消耗5.1 mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
证明溴乙烷中溴元素的存在,有下列几步,其正确的操作顺序是________(填序号)。
①加入硝酸银溶液 ②加入氢氧化钠溶液 ③加热 ④加入蒸馏水 ⑤加入稀硝酸至溶液呈酸性 ⑥加入氢氧化钠醇溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构简式为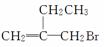 。下列关于该物质的说法中正确的是( )
。下列关于该物质的说法中正确的是( )
A.该物质可以发生水解反应
B.该物质能和AgNO3溶液反应产生AgBr沉淀
C.该物质可以发生消去反应
D.该物质分子中至多有4个碳原子共面
查看答案和解析>>
科目:高中化学 来源: 题型:
玫瑰的香味物质中包含苧烯,苧烯的键线式为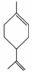 。
。
(1)1 mol苧烯最多可以跟________mol H2发生反应。
(2)写出苧烯跟等物质的量的Br2发生加成反应所得产物的可能的结构______________(用键线式表示)。
(3)有机物A是苧烯的同分异构体,分子中含有“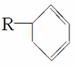 ”结构,A可能的结构为________________________________________________________________________
”结构,A可能的结构为________________________________________________________________________
___________________________________________________________(用键线式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
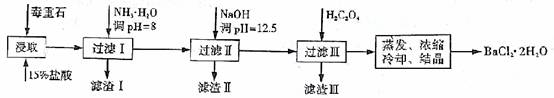
(1)毒重石用盐酸浸取前需充分研磨,目的是 。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的 。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
加入NH3·H2O调节pH=8可除去 (填离子符号),滤渣Ⅱ中含 (填化学式)。加入H2C2O4时应避免过量,原因是 。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)利用简洁酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42—+2H+=Cr2O72—+H20 Ba2++CrO42—=BaCrO4↓
步骤Ⅰ 移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL。
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的 (填“上方”或“下方”)。BaCl2溶液的浓度为 mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将 (填“偏大”或“偏小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com