
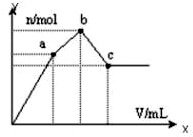
 向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示.则下列说法中正确的是( )
向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示.则下列说法中正确的是( )| A、c点溶液呈碱性 |
| B、b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ |
| C、c点加入Ba(OH)2溶液的体积为200 mL |
| D、a点的溶液呈中性 |
| 0.025mol |
| 0.1mol/L |


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(A)=0.15 mol?L-1?min-1 |
| B、v(B)=0.02 mol?L-1?s-1 |
| C、v(C)=0.40 mol?L-1?min-1 |
| D、v(D)=0.45 mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热稳定性:NaHCO3>Na2CO3 |
| B、等物质的量浓度的Na2CO3溶液和NaHCO3溶液,前者pH小 |
| C、NaHCO3和Na2CO3的与等物质的量浓度的稀盐酸反应,NaHCO3反应速率更快 |
| D、等物质的量的NaHCO3和Na2CO3的与足量稀盐酸反应,NaHCO3放出的CO2多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水解达到平衡(不饱和)时,无论加氯化铁饱和溶液还是加水稀释,平衡均向正方向移动 |
| B、浓度为5mol/L和0.5mol/L的两种FeCl3溶液,其它条件相同时,Fe3+的水解程度前者比后者低 |
| C、有50℃和20℃的相同浓度氯化铁溶液,其他条件相同时,Fe3+的水解程度前者比后者小 |
| D、为抑制Fe3+水解,较好地保存FeCl3溶液,应加少量盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com