
| A | A的最高价氧化物对应的水化物化学式为H2AO3 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色 |
| D | Z的基态原子最外层电子排布式为3s23p2 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
 3Cu+N2+3H2O;(4)H2O2+2e-+2H+=2H2O;
3Cu+N2+3H2O;(4)H2O2+2e-+2H+=2H2O; 3Cu+N2+3H2O。(4)Cu单质和过氧化氢在稀硫酸中可反应,可将这个反应设计成原电池,正极反应方程式H2O2+2e-+2H+=2H2O;负极的电极反应式为Cu-2e-=Cu2+。(5) ①-②整理可得:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1KJ/mol。
3Cu+N2+3H2O。(4)Cu单质和过氧化氢在稀硫酸中可反应,可将这个反应设计成原电池,正极反应方程式H2O2+2e-+2H+=2H2O;负极的电极反应式为Cu-2e-=Cu2+。(5) ①-②整理可得:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1KJ/mol。

科目:高中化学 来源:不详 题型:单选题
| A.元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子 |
| B.元素T、Q、W、Y的原子半径大小为:T<Q<Y<W |
| C.Q与Y组成的常见物质是一种两性物质,结构中含有共价键 |
| D.由Y和T组成的物质YT,在电子和陶瓷工业上有广泛应用,可以直接由单质Y和T在低温下合成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | —— |
| 最低负价 | —— | -1 | —— | —— | -3 | -2 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.XeF4分子中各原子均达到8电子稳定结构 |
| B.XeF4分子中Xe的化合价为0价 |
| C.上述反应中氧化剂和还原剂的物质的量之比为2∶3 |
| D.XeF4按上述方式水解,每生成4molXe,转移16mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子最外层电子数为2的元素一定处于周期表ⅡA族 |
| B.主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5 |
| C.离子化合物中不可能存在共价键 |
| D.金属元素与非金属元素形成的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

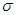 键与π键的数目之比为_________;
键与π键的数目之比为_________;查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性:R>W |
| C.WX3和水反应形成离子化合物 |
| D.Y和Z两者最高价氧化物对应的水化物不能相互反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com