
(1)��A��B����ʼŨ�ȷֱ�Ϊ2 mol��L-1��1 mol��L-1��ƽ��ʱA��B��C��Ũ��ȡֵ��Χ�ֱ���___________________����A��C����ʼŨ�ȷֱ�Ϊ2 mol��L-1��2 mol��L-1��ƽ��ʱA��B��C��Ũ��ȡֵ��Χ�ֱ��ǣ�____________________________��
(2)��ƽ��ʱA��B��C��Ũ�ȷֱ�Ϊa mol��L-1��d mol��L-1��a mol��L-1����ʼʱA��B��C��Ũ�ȷֱ���___________________���ı������ﵽ��ƽ��ʱ��ʹB��Ũ�ȱ仯��ΧΪ0.5d mol��L-1��1.5d mol��L-1����Ӧ�����������___________________��
���������۷�Ӧ��ȡֵ��Χ�����ں�������֪�������Ϸ�Ӧ��������������۹������⣬����������⡣��A��C����ʼŨ�ȷֱ�Ϊ2 mol��L-1��2mol��L-1ʱ������B����ʼŨ��Ϊ0 mol��L-1��Ϊ�������������ʼ2 mol��L-1��A�����ܷ�Ӧת�������C�ı仯��ΧҲֻ����0��2 mol��L-1��
ƽ��ʱA��B��C��Ũ�ȷֱ�Ϊa mol��L-1��d mol��L-1��a mol��L-1���䷴Ӧ���ܴ�����Ӧ��ʼ��Ҳ���ܴ��淴Ӧ��ʼ�������淴Ӧ��ʼʱ�����ڽ��з�ӦC���ʲ��ܵõ�ƽ��ʱ��A��B��C��Ũ�ȣ�����Ҫ����һ������A��B���ʡ�����ѡ��A��B���ʹ�A��B֮��Ĺ�����������жϡ�
��a��2dʱ����ζAΪ��������B����ʼŨ��Ϊ0 mol��L-1��4d mol��L
��a��2dʱ��B������A��B��C��Ũ�ȷֱ��ǣ�0 mol��L-1��(d-0.5a) mol��L-1��
�ı�������ʹB��ƽ��Ũ����0.5d mol��L-1��1.5d mol��L-1��Χ�ڱ仯��Ҳ��������A��B��C��ȡֵ��Χ��ʵ���Ͼ���Ҫ��һ������A����������B(��d mol��L-1���ٵ�0.5d mol��L-1)����C�����ݷ���ʽϵ����ϵA��������Ϊd mol��L-1�������е�A(a mol��L-1)Ӧ����d mol��L-1��ͬ����B��������ʱ��C��������Ϊ2d mol��L-1�������е�C(a mol��L-1)Ӧ����2d mol��L-1�����߶����㣺a��2d��
�𰸣�(1)A��0��2 mol��L-1 B��0��1 mol��L-1 C��0��4 mol��L-1��
A:2��3 mol��L-1 B:0��0.5 mol��L-1 C:0��2 mol��L-1
(2)A:
��a��2d��A��(a-2d)mol��L-1 B��0 mol��L-1 C��(a+4d) mol��L-1
��a��2d��A��0 mol��L-1 B��(d-0.5a) mol��L-1 C��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� ��� |
�¶� /�� |
��ʼ��/mol | ƽ����/mol | �ﵽƽ���ʱ��/min | ��ƽ��ʱ��ϵ�����ı仯/kJ | ||
| CO | H2O | CO2 | H2 | ||||
| �� | 650 | 1 | 2 | 0.4 | 0.4 | 5 | 16.4kJ |
| �� | 650 | 2 | 4 | t1 | Q1 kJ | ||
| �� | 900 | 2 | 4 | 1.6 | 1.6 | t2 | Q2 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
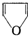 �������������߾���
�������������߾��� �ṹ���л�������������������ʪ����ľƬʱ��������ɫ�ķ�Ӧ��������Ƭ��Ӧ��
�ṹ���л�������������������ʪ����ľƬʱ��������ɫ�ķ�Ӧ��������Ƭ��Ӧ�� ��Ϊͬ���칹���Ҿ�����Ƭ��Ӧ�������л���Ľṹ��ʽ
��Ϊͬ���칹���Ҿ�����Ƭ��Ӧ�������л���Ľṹ��ʽ



 �����������ϡ����ᡢҽҩ���������ϣ���ȩ��NaOH��Һ�����·�������������ԭ��Ӧ�õ����־���૽ṹ���л�����ǵĽṹ��ʽΪ
�����������ϡ����ᡢҽҩ���������ϣ���ȩ��NaOH��Һ�����·�������������ԭ��Ӧ�õ����־���૽ṹ���л�����ǵĽṹ��ʽΪ





�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ����x��ʱ��/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
| һ������ |

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com