
| A、①②③④ | B、②③④ |
| C、②③ | D、①④ |


科目:高中化学 来源: 题型:
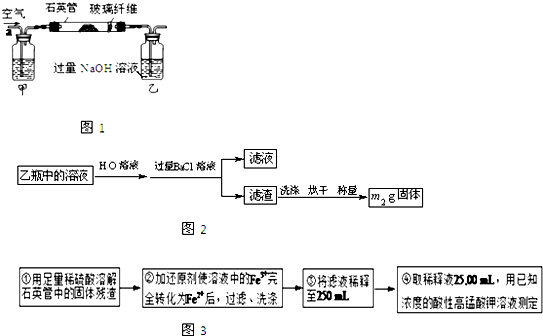
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
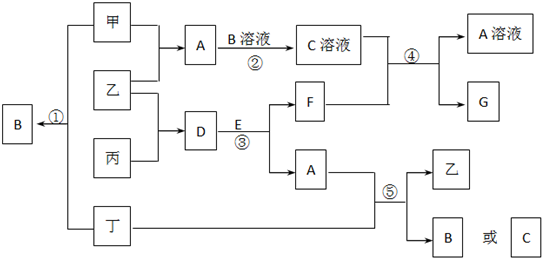
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
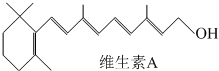
查看答案和解析>>
科目:高中化学 来源: 题型:
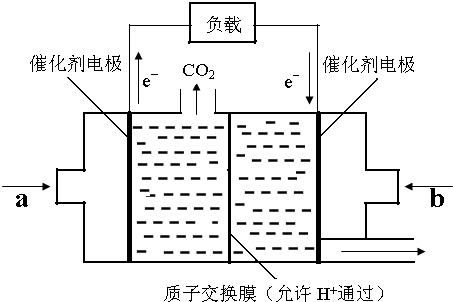
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铝可以用来制造耐火坩埚、耐火管和耐高温的实验仪器 |
| B、潜水艇在紧急情况下可用过氧化钠供氧 |
| C、氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 |
| D、工业上常用硅制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热,观察是否有气体放出 |
| B、溶于水后加BaC12,看有无沉淀 |
| C、溶于水后加石灰水,看有无沉淀 |
| D、取固体变色试样加盐酸,看是否有气泡产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com