
| A. | CH4和C2H4 | B. | C2H2和C2H4 | C. | C2H4和C2H6 | D. | C4H8和C3H6 |
分析 在120℃时水是气态,在120℃时某烃和过量O2在一密闭容器中完全反应,测知反应前后的压强没有变化,说明反应前后气体体积之和不变,则反应前后气体计量数之和不变,据此判断烃.
解答 解:在120℃时水是气态,在120℃时某烃和过量O2在一密闭容器中完全反应,测知反应前后的压强没有变化,说明反应前后气体体积之和不变,则反应前后气体计量数之和不变,
设烃的分子式为CxHy,发生的反应为CxHy+(x+$\frac{y}{4}$)O2$\stackrel{燃烧}{→}$xCO2+$\frac{y}{2}$H2O,反应前后气体体积之和不变、计量数之和不变,所以1+x+$\frac{y}{4}$=x+$\frac{y}{2}$,y=4,符合条件的是A,故选A.
点评 本题考查化学方程式有关计算,明确反应前后气体计量数之和不变是解本题关键,根据方程式分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NO | B. | N2O | C. | NO2 | D. | N2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
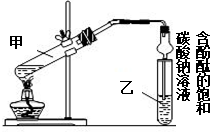 某学习小组在实验室制取乙酸乙酯的主要步骤如下:
某学习小组在实验室制取乙酸乙酯的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
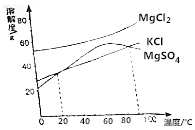 我国食盐有80%来自底下井盐和岩盐,用盐井水晒盐是制取食盐的常用方法.
我国食盐有80%来自底下井盐和岩盐,用盐井水晒盐是制取食盐的常用方法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe3+、SO42-、Cl- | B. | Mg2+、Ag+、CO32-、Cl- | ||
| C. | K+、NH4+、SO42-、Cl- | D. | K+、Na+、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
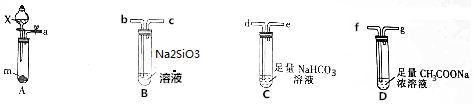
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10% | B. | 25% | C. | 50% | D. | 67% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com