

分析 (1)先根据图2找出2、4、6min时刻时的氢气体积的变化量,再找出2、4、6min时刻时的速率与时间的关系,然后用平滑曲线描绘图象.
(2)根据该反应的反应热及溶液中氢离子的浓度判断.
(3)原因②:先确定Cl-对反应没有影响再猜测硫酸根离子的作用;
原因⑤:根据原因④提出与原因⑤相反的观点;
(4)根据a、b对比实验中的现象判断原因③;
(5)影响该化学反应速率的因素可能是温度、浓度、接触面积和催化剂等,据此分析.
解答 解:(1)2、4、6min时刻时氢气体积的分别为10 mL、20mL、36mL,其平均反应速率分别为5 mL/min、7.5mL/min、6mL/min,然后标出速率与时间图象为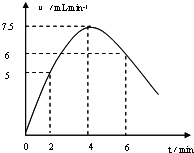 ,故答案为:
,故答案为:
(2)该反应是放热反应,随着反应的进行,放出的热量越多,溶液的温度越高,反应速率越大;随着反应的进行,溶液中氢离子的浓度逐渐减小,浓度越小,反应速率越小,
故答案为:镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大;4min后由于溶液中H+浓度降低,所以导致反应速率减小;
(3)②根据原因①结合题意,提出与原因①相反的观点,
故答案为:Cl-对反应没有影响,而SO42-对反应具有阻碍作用;
⑤根据原因④结合题意,提出与原因④相反的观点,
故答案为:Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大);
(4)a中原来时快有硫酸根离子,后加入氯离子,如果氯离子有促进作用,那么反应速率就比未加时快,以此证明原因③是正确的.
b中中原来时快有氯离子,后加入硫酸根离子,如果硫酸根离子有阻碍作用,那么反应速率比未加时慢,以此说明因Ⅲ是正确的.
故答案为:反应速率加快; 反应速率减慢.
(5)①加入某种催化剂,可以加快反应速率,故①正确;
②加入硫酸铜溶液,Al能够置换出铜,形成铝铜原电池,加快反应速率,故②正确;
③将铝片剪成100 条,增大了反应物的接触面积,反应速率加快,故③正确;
④硫酸的浓度至18mol/L时,Al在其中会钝化,故④错误;
⑤加入蒸馏水,降低氢离子浓度,反应速率减慢,故⑤错误;
⑥加入少量KNO3 溶液,溶液中氢离子与硝酸根离子和Al反应生成NO,不生成氢气,故⑥错误;
⑦升高温度,反应速率加快,故⑦正确;
故答案为:④⑤⑥.
点评 本题考查应向化学反应速率的实验探究,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握实验原理,为解答该题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和反应是吸热反应 | |
| B. | 燃烧属于放热反应 | |
| C. | 断裂化学键要放出能量 | |
| D. | 反应物总能量一定等于生成物总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2SO3、2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4.
H2SO3、2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0 | B. | 175 | C. | 57 | D. | 118 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液使酚酞试液变红:S2-+2H2O?2OH-+H2S | |
| B. | 用右图装置电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | NaHCO3溶液使酚酞试液变红:HCO3-+H2O?H3O++CO32- | |
| D. | 用AlCl3溶液使石蕊试液变红:Al3++3H2O?Al(OH)3+3 H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素形成的单质熔沸点自上而下逐渐升高 | |
| B. | 核外电子排布相同的微粒化学性质不一定相同 | |
| C. | 第三周期中,除稀有气体元素外原子半径最大的是氯 | |
| D. | 同主族元素氢化物的稳定性越强其沸点就越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Li>Na | B. | 最外层电子数都相同 | ||
| C. | 核外电子层数相同 | D. | 核外电子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:Ba(OH)2>Mg(OH)2>Be(OH)2 | ||
| C. | 非金属性:F>C>O | D. | 气态氢化物稳定性:HF>HCl>H2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com