
����Ŀ��Ϊ��̽��H2O2��H2SO3��Br2�����Ե����ǿ�����������ʵ�飨�г���������ȥ������ش��������⣺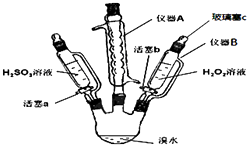
��1������A������ �� �������� ��
��2��������B�μ�Һ�岢����Ҫ������c��ԭ���� ��
��3��ʵ���¼���£��벹ȫ�հף���
���� | ʵ����� | ʵ������ | ʵ����� |
�� | ����a����μ���H2SO3��Һ������ | ||
�� | �����������Һ����μ���H2O2��Һ | �տ�ʼ��Һ��ɫ�����Ա仯�������μӣ���Һ��Ϊ�Ȼ�ɫ |
��4��������У���ʼʱ��ɫ�����Ա仯��ԭ���ǣ�д��һ���� �� ������з�Ӧ�����ӷ���ʽ ��
���������Ҫ��Ӧ�����ӷ���ʽ ��
���𰸡�
��1�����������ܣ����������壬������ӷ�
��2����Һ©��������ƿ��ͨ����ѹ���
��3���Ȼ�ɫ��ȥ��Br2�������Դ���H2SO3��H2O2�������Դ���Br2
��4������1��H2SO3�й�����H2O2�Ⱥ�H2SO3��Ӧ��H2SO3+Br2+H2O=4H++SO ![]() +2Br����H2O2+2Br��+2H+=Br2+2H2O
+2Br����H2O2+2Br��+2H+=Br2+2H2O
���������⣺��1������A����������������ܣ���������ʹ�������������������Դ��ǣ����������ܣ����������壬������ӷ�����2��������B�μ�Һ�岢����Ҫ������c��ԭ���Ǹ�����������ƿ��ͨ����ѹ��ȣ�Һ����˳�����������Դ��ǣ���Һ©��������ƿ��ͨ����ѹ��ȣ���3������a����μ���H2SO3��Һ��������H2SO3����ˮ��������Һ�ijȻ�ɫ��ȥ��˵���嵥�ʵ�������ǿ��������������������Һ����μ���H2O2��Һ����Һ�ֱ�Ϊ�Ȼ�ɫ��˵���������⽫����������Ϊ�嵥�ʣ���H2O2�������Դ���Br2 �� ���Դ��ǣ�
���� | ʵ����� | ʵ������ | ʵ����� |
�� | ����a����μ���H2SO3��Һ������ | �Ȼ�ɫ��ȥ | Br2�������Դ���H2SO3 |
�� | �����������Һ����μ���H2O2��Һ | �տ�ʼ��Һ��ɫ�����Ա仯�������μӣ���Һ��Ϊ�Ȼ�ɫ | H2O2�������Դ���Br2 |
����4��������У���ʼʱ��ɫ�����Ա仯��������Ϊ������1��H2SO3�й�����H2O2�Ⱥ�H2SO3��Ӧ����H2O2Ũ��С��Br����H2O2��Ӧ���ȣ�������У����������嵥�ʷ�Ӧ���ӷ���ʽΪ��H2SO3+Br2+H2O=4H++SO ![]() +2Br�� �� ���������Ҫ������������������ӵķ�Ӧ�����ӷ���ʽΪ��H2O2+2Br��+2H+=Br2+2H2O�����Դ��ǣ�����1��H2SO3�й�����H2O2�Ⱥ�H2SO3��Ӧ��H2SO3+Br2+H2O=4H++SO
+2Br�� �� ���������Ҫ������������������ӵķ�Ӧ�����ӷ���ʽΪ��H2O2+2Br��+2H+=Br2+2H2O�����Դ��ǣ�����1��H2SO3�й�����H2O2�Ⱥ�H2SO3��Ӧ��H2SO3+Br2+H2O=4H++SO ![]() +2Br����H2O2+2Br��+2H+=Br2+2H2O��
+2Br����H2O2+2Br��+2H+=Br2+2H2O��


 ��ĩ1�����ʽ���������ϵ�д�
��ĩ1�����ʽ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�������ƽ��������Ϊ126���춬������R��Ϊ����C2H4ON�������з���ʽΪCXHYOZN17S2��һ����������������2���춬����������ɡ���ö��ĵķ��������ԼΪ
A. 1638B. 1854C. 1890D. 2142
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ס��������л�������ڳ��³�ѹ�·��룬��֪���ǵ������������£�
���� | �ܶȣ�g/ml��3�� | �е㣨�棩 | ˮ���� | �ܽ��� |
�� | 0.7893 | 78.5 | �� | ������ |
�� | 1.220 | 100.7 | �� | ���ڼ� |
����õķ��뷽���ǣ� ��
A.��Һ
B.����
C.����
D.��ȡ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��ͬѧΪ��̽��ͭ��Ũ����ķ�Ӧ������������ʵ�飬ʵ��װ����ͼ��ʾ��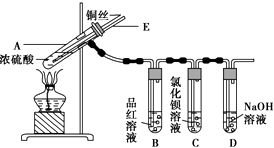
ʵ�鲽�裺
����������ͼ��ʾ��װ�ã����������ԣ��ټ����Լ���
�ڼ���A�Թܣ���B�Թ���Ʒ����Һ��ɫ��Ϩ��ƾ��ƣ�
�۽�Cu˿���ϳ鶯�뿪Һ�森
��ش��������⣺
��1��A�Թ��з�����Ӧ�Ļ�ѧ����ʽΪ ��
��2���ܹ�֤��ͭ��Ũ���ᷴӦ���������ʵ�������� ��
��3����ʢ��BaCl2��Һ��C�Թ��У����˵��ܿ��������⣬���������������������е���Һ�ֳ����ݣ��ֱ�μ�������Һ�������������Ļ�ѧʽ������ж�Ӧ��λ�ã�
�μӵ���Һ | ��ˮ | ��ˮ |
�����Ļ�ѧʽ |
д������SO2���ֻ�ԭ�Ե����ӷ�Ӧ����ʽ�� ��
��4��ʵ����Ϻ���Ϩ��ƾ��ƣ����ڵ���E�Ĵ��ڣ��Թ�B�е�Һ�岻�ᵹ�����Թ�A�У���ԭ���� ��
��5��ʵ����Ϻ�װ���в����������ж������ܴ����ϵĽ�����Ϊ�˷�ֹ�����������������Ⱦ���������װ��ǰ��Ӧ����ȡ�IJ����� ��
��6����SO2����ͨ�뺬��n mol Na2S����Һ�У���ַ�Ӧ����Һ�г��ֻ�ɫ���ǣ��Է�������Һ���������SO2����mol���������ܽ��SO2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����þƾ���ֱ�Ӽ��ȵ������ǣ���������
A. ��Ͳ B. ����ƿ C. �Թ� D. �ձ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��6�������ᣨG���Ǻϳ���������Ҫԭ��֮һ�����ú�����̼ԭ�ӵ��л������������Ʊ�����ͼΪAͨ��������Ӧ�Ʊ�G�ķ�Ӧ���̣����ܵķ�Ӧ�м�����ΪB��C��D��E��F���� 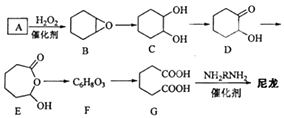
��1��������A�к�̼87.8%������Ϊ�⣬A�Ļ�ѧ����Ϊ ��
��2��C��D �ķ�Ӧ����Ϊ ��
��3��F�Ľṹ��ʽΪ ��
��4��B��C��D�����м������У��˴Ź������׳��������� �� ���ٵ��� ��
��5��������һ���л��߷��ӻ������G�ϳ������Ļ�ѧ����ʽΪ ��
��6����Aͨ��������Ӧ�Ʊ�1��3��������ϩ�ĺϳ�·��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���ʵ��������������ó��Ľ�����ȷ����( )
ѡ�� | ʵ����� | ʵ������ | ���� |
A | ������Xͨ��Ʒ����Һ�� | ��ɫ��ȥ | Xһ����SO2 |
B | ����ɫ��Һ�м������ữ��BaCl2��Һ | �а�ɫ���� | ԭ��Һ��һ����SO |
C | ��Na2SiO3��Һ��ͨ������CO2���� | ���ְ�ɫ���� | H2CO3�����Ա�H2SiO3ǿ |
D | ��ij��Һ���ȼ���ˮ�ټ�KSCN��Һ | ��Һ��Ѫ��ɫ | ԭ��Һ��һ����Fe2�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ� ��
A.����ʯ����ᷴӦ��ȡ������̼��CaCO3+2H+�TCa2++CO2��+H2O
B.����������������������Һ���ȣ�CH2ClCOOH+OH����CH2ClCOO��+H2O
C.��������Һ������ȩ�е�ȩ����CH3CHO+2[Ag��NH3��2]++2OH�� ![]() CH3COO��+NH4++3NH3+2Ag��+H2O
CH3COO��+NH4++3NH3+2Ag��+H2O
D.��������Һ��ͨ������������̼��2C6H5O��+CO2+H2O��2C6H5OH+CO ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ɫ��������A�ڿ����м���ȼ��ʱ������ɫ����,�õ�����ɫ����B,B ����������D��Ӧ������C,A¶���ڿ������㹻��ʱ��Ҳ���ΪC,E��D��ӦҲ������C,A��B������ˮ��Ӧ����E���ش���������:
��1��д���������ʵĻ�ѧʽ:A________, B________, C________,D________, E________��
��2��д�����з�Ӧ�Ļ�ѧ����ʽ:
��A����B:________;
��B��ˮ��Ӧ����E:________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com