
”¾ĢāÄæ”æ±ź×¼×“æöĻĀ£¬ČŻ»żĪŖVmLµÄÉÕĘæ³äĀśNH3£¬ÉčNAĪŖ°¢·üŁ¤µĀĀŽ³£ŹżµÄÖµ”£
£Ø1£©¼ÆĀśæÕĘųŹ±£¬øĆÉÕĘæ×ÜÖŹĮæĪŖa g£¬Ōņ¼ÆĀśNH3Ź±øĆÉÕĘæ×ÜÖŹĮæĪŖ____________
£Ø2£©ÉÕĘæÖŠĘųĢåŌ×ÓµÄ×ÜŹżŹĒ______________
£Ø3£©ŅŃÖŖNH3µÄĆܶȱČæÕĘųŠ”£¬¼«Ņ×ČÜÓŚĖ®£¬°±ČÜÓŚĖ®ŠĪ³ÉµÄČÜŅŗ³ĘĪŖ°±Ė®”£ÓĆÉÕĘæÖŠµÄNH3×öÅēČŖŹµŃ飬Ė®³äĀśÉÕĘ棬ĖłµĆČÜŅŗµÄĆܶČĪŖ¦Ńg/mL£¬¼ŁÉčNH3ƻӊĖšŹ§£¬øĆČÜŅŗÖŠČÜÖŹµÄÖŹĮæ·ÖŹżĪŖ______£¬ĪļÖŹµÄĮæÅضČĪŖ_______mol/l
”¾“š°ø”æ£Ø![]() £©g
£©g ![]()
![]()
![]()
”¾½āĪö”æ
£Ø1£©±ź×¼×“æöĻĀ£¬ VmLNH3µÄĪļÖŹµÄĮæĪŖ £¬ŌņNH3µÄÖŹĮæĪŖ
£¬ŌņNH3µÄÖŹĮæĪŖ![]() ”£¼ÆĀśæÕĘųŹ±£¬æÕĘųµÄÖŹĮæĪŖ
”£¼ÆĀśæÕĘųŹ±£¬æÕĘųµÄÖŹĮæĪŖ![]() ”£¼ŁÉčÉÕĘæµÄÖŹĮæĪŖmg£¬Ōņa=(m+
”£¼ŁÉčÉÕĘæµÄÖŹĮæĪŖmg£¬Ōņa=(m+![]() )g£¬ĖłŅŌm=(a-
)g£¬ĖłŅŌm=(a-![]() )g£¬Čō¼ÆĀśNH3£¬øĆÉÕĘæµÄ×ÜÖŹĮæĪŖmg+
)g£¬Čō¼ÆĀśNH3£¬øĆÉÕĘæµÄ×ÜÖŹĮæĪŖmg+![]() = a-
= a-![]() +
+![]() =(
=(![]() )gӣ
)gӣ
£Ø2£©NH3µÄĪļÖŹµÄĮæĪŖ![]() £¬ŌņŌ×ÓµÄ×ÜĪļÖŹµÄĮæĪŖ
£¬ŌņŌ×ÓµÄ×ÜĪļÖŹµÄĮæĪŖ![]() ”Į4=
”Į4=![]() mol£¬Ō×Ó×ÜŹżĪŖ
mol£¬Ō×Ó×ÜŹżĪŖ![]() ”£
ӣ
£Ø3£©¼ŁÉčÉÕĘæµÄČŻ»żĪŖ1L£¬ŌņNH3µÄĢå»żĪŖ1L£¬×öĶźÅēČŖŹµŃéŗó£¬ČÜŅŗĢå»żŅ²ĪŖ1L”£±ź×¼×“æöĻĀ£¬1L NH3µÄĪļÖŹµÄĮæĪŖ1/22.4mol£¬ÖŹĮæĪŖ17/22.4g£¬1LČÜŅŗµÄÖŹĮæĪŖ1000¦Ńg£¬ĖłŅŌČÜÖŹµÄÖŹĮæ·ÖŹżĪŖ ”£ĪļÖŹµÄĮæÅضČĪŖ
”£ĪļÖŹµÄĮæÅضČĪŖ ”£¹Ź“š°øĪŖ£ŗ
”£¹Ź“š°øĪŖ£ŗ![]() £¬
£¬![]() ”£
ӣ


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫Ņ»¶ØĮæµÄŃõ»ÆĶ¼ÓČėµ½10.0mL2.50mol/LµÄĻ”ĮņĖįÖŠ£¬“żĘäĶźČ«Čܽāŗó£¬ŌŁĻņĄ¶É«ČÜŅŗÖŠ¼ÓČė2.06gĢś·Ū£¬¾½Į°č”¢¹żĀĖ”¢Ļ“µÓ”¢øÉŌļµČ²Ł×÷£¬×īŗóµĆµ½¹ĢĢåµÄÖŹĮæĪŖ1.94g”£ĶعżŹż¾ŻµÄ±Č½ĻĖµĆ÷øÉŌļŗóµĆµ½µÄ¹ĢĢåŹĒŹ²Ć“ĪļÖŹ£æ____ĒóŌŃõ»ÆĶµÄÖŹĮæ___”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ±ź×¼×“æöĻĀÓŠ£ŗ¢Ł6.72LCH4£¬¢Ś3.01”Į1023øöHCl·Ö×Ó£¬¢Ū13.6gH2S£¬¢Ü0.2molNH3”£ĻĀĮŠ¶ŌÕāĖÄÖÖĘųĢåµÄĆčŹöÕżČ·µÄŹĒ£Ø £©
a£®Ģå»ż¢Ś>¢Ū>¢Ł>¢Ü b£®ĆÜ¶Č¢Ś>¢Ū>¢Ü>¢Ł
c£®ÖŹĮæ¢Ś>¢Ū>¢Ł>¢Ü d£®ĒāŌ×ÓøöŹż¢Ł>¢Ū>¢Ü>¢Ś
A.abcB.bcdC.cbdD.abcd
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ·“Ó¦ŌŚČĪŗĪĪĀ¶ČĻĀ¾łÄÜ×Ō·¢½ųŠŠµÄŹĒ
A. 2N2(g)£«O2(g)===2N2O(g) ¦¤H£½£«163 kJ”¤mol£1
B. Ag(s)£«Cl2(g)===AgCl(s) ¦¤H£½£127 kJ”¤mol£1
C. HgO(s)===Hg(l)£«O2(g) ¦¤H£½£«91 kJ”¤mol£1
D. H2O2(l)===O2(g)£«H2O(l) ¦¤H£½£98 kJ”¤mol£1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij¶žŌŖČõĖįH2AČÜŅŗ£¬°“ĻĀŹ½·¢ÉśµēĄė£ŗH2A![]() H£«£«HA£”¢HA£
H£«£«HA£”¢HA£![]() H£«£«A2££¬ĻĀĮŠĖÄÖÖČÜŅŗÖŠc(H2A)×ī“óµÄŹĒ(””””)
H£«£«A2££¬ĻĀĮŠĖÄÖÖČÜŅŗÖŠc(H2A)×ī“óµÄŹĒ(””””)
A. 0.01 mol”¤L£1µÄH2AČÜŅŗ
B. 0.01 mol”¤L£1µÄNaHAČÜŅŗ
C. 0.02 mol”¤L£1µÄŃĪĖįÓė0.04 mol”¤L£1µÄNaHAČÜŅŗµČĢå»ż»ģŗĻŅŗ
D. 0.02 mol”¤L£1µÄNaOHÓė0.02 mol”¤L£1µÄNaHAČÜŅŗµČĢå»ż»ģŗĻŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ÆѧøÅÄīŌŚĀß¼ÉĻ“ęŌŚČēĻĀ¹ŲĻµ£ŗ

¶ŌĻĀĮŠøÅÄīµÄĖµ·ØÕżČ·µÄŹĒ
A. »ÆŗĻĪļÓė“æ¾»ĪļŹōÓŚÖŲµž¹ŲĻµ
B. ·Ö½ā·“Ó¦Óėø“·Ö½ā·“Ó¦ŹōÓŚ²¢ĮŠ¹ŲĻµ
C. »ÆŗĻĪļÓė½šŹōŃõ»ÆĪļŹōÓŚ½»²ę¹ŲĻµ
D. ÄĘŃĪÓėĢ¼ĖįŃĪŹōÓŚ²¢ĮŠ¹ŲĻµ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”湤ŅµÉĻŅ»°ćŌŚŗćČŻĆܱÕČŻĘ÷ÖŠæÉŅŌ²ÉÓĆĻĀĮŠ·“Ó¦ŗĻ³É¼×“¼£ŗCO£Øg£©+2H2£Øg£© ![]() CH3OH£Øg£© ¦¤H
CH3OH£Øg£© ¦¤H
£Ø1£©ÄÜÅŠ¶Ļ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ__________(Ģī×ÖÄøŠņŗÅ)”£
A£®2 ¦ĶÄę(H2) = ¦Ķ Õż(CO)
B£®»ģŗĻĘųĢåµÄĆÜ¶Č²»±ä
C£®»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»±ä
D£®CH3OH”¢CO”¢H2µÄÅØ¶Č¶¼²»ŌŁ·¢Éś±ä»Æ
E£®ČŻĘ÷ÄŚCO”¢H2”¢CH3OHµÄÅضČÖ®±ČĪŖ1:2:1
F£®CO”¢H2”¢CH3OHµÄĖŁĀŹÖ®±ČĪŖ1:2:1
£Ø2£©COŌŚ²»Ķ¬ĪĀ¶ČĻĀµÄĘ½ŗā×Ŗ»ÆĀŹÓėŃ¹ĒæµÄ¹ŲĻµČēĶ¼1£¬øĆ·“Ó¦”÷H_______0£ØĢī”°£¾”±»ņ”°£¼”±£©
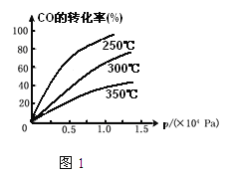
£Ø3£©Ņ»¶ØĪĀ¶ČĻĀ,½«4a mol H2ŗĶ2a mol CO·ÅČė2LµÄĆܱÕČŻĘ÷ÖŠ£¬³ä·Ö·“Ó¦ŗó²āµĆCOµÄ×Ŗ»ÆĀŹĪŖ50£„£¬Ōņ£ŗ
¢ŁøĆ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ_______________”£
¢ŚČō“ĖŹ±ŌŁĻņøĆČŻĘ÷ÖŠĶ¶Čėa mol CO”¢2a mol H2ŗĶa mol CH3OH£¬ÅŠ¶ĻĘ½ŗāŅĘ¶ÆµÄ·½ĻņŹĒ_______________£Ø”°ÕżĻņŅĘ¶Æ”±”¢”°ÄęĻņŅĘ¶Æ”±»ņ”°²»ŅĘ¶Æ”±£©£»
¢ŪŌŚĘäĖūĢõ¼ž²»±äµÄĒéæöĻĀ£¬½«ČŻĘ÷Ģå»żŃ¹Ėõµ½ŌĄ“µÄ![]() £¬ÓėŌĘ½ŗāĻą±Č£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ_____________£ØĢī×ÖÄø£©”£
£¬ÓėŌĘ½ŗāĻą±Č£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ_____________£ØĢī×ÖÄø£©”£
A£®H2µÄÅØ¶Č¼õŠ”£» B£®Õż·“Ó¦ĖŁĀŹ¼Óæģ£¬Äę·“Ó¦ĖŁĀŹŅ²¼Óæģ£»
C£®¼×“¼µÄĪļÖŹµÄĮæŌö¼Ó£» D£®ÖŲŠĀĘ½ŗāŹ±£¬![]() Ōö“ó£»
Ōö“ó£»
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾ŻĻĀĮŠŹµŃéĻÖĻó£¬ĖłµĆ½įĀŪÕżČ·µÄŹĒ£Ø £©

ŹµŃé | ŹµŃéĻÖĻó | ½įĀŪ |
A | ×óÉÕ±ÖŠĢś±ķĆęÓŠĘųÅŻ£¬ÓŅ±ßÉÕ±ÖŠĶ±ķĆęÓŠĘųÅŻ | Ńõ»ÆŠŌ£ŗAl3+£¾Fe2+£¾Cu2+ |
B | ×ó±ßĆŽ»Ø±äĪŖ³ČÉ«£¬ÓŅ±ßĆŽ»Ø±äĪŖĄ¶É« | Ńõ»ÆŠŌ£ŗCl2£¾Br2£¾I2 |
C | ÓŅÉÕ±ÖŠ³ĪĒåŹÆ»ŅĖ®±ä»ė×Ē£¬×ó±ßÉÕ±ÖŠĪŽĆ÷ĻŌ±ä»Æ | ČČĪČ¶ØŠŌ£ŗNa2CO3£¾NaHCO3 |
D | ׶ŠĪĘæÖŠÓŠĘųĢå²śÉś£¬ÉÕ±ÖŠŅŗĢå±ä»ė×Ē | ·Ē½šŹōŠŌ£ŗCl£¾C£¾Si |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”沶Ģ¼¼¼ŹõŹĒÖø“ÓæÕĘųÖŠ²¶»ń¶žŃõ»ÆĢ¼µÄø÷ÖÖæĘѧ¼¼ŹõµÄĶ³³Ę”£Šķ¶ąæĘѧ¼ŅČĻĪŖ“ÓæÕĘųÖŠ²¶»ń¶žŃõ»ÆĢ¼²»½öŌŚĄķĀŪÉĻæÉŠŠ£¬ŗÜæģ»¹»į³ÉĪŖŅ»øö¶Ōø¶Č«Ēņ±äÅÆµÄŹµÓĆĪäĘ÷£»ÄæĒ° NH3ŗĶ(NH4)2CO3µČĪļÖŹŅŃ¾±»ÓĆ×÷¹¤Ņµ²¶Ģ¼¼Į”£
£Ø1£©ĻĀĮŠĪļÖŹÖŠ²»æÉÄÜ×÷ĪŖCO2²¶»ń¼ĮµÄŹĒ_________”£
A£®NH4Cl B£®CH3CH2OH C£®CaCl2 D£®Na2CO3
£Ø2£©¹¤ŅµÉĻÓĆNH3²¶Ģ¼æÉŗĻ³ÉCO (NH2)2£ŗŅŃÖŖ£ŗ¢Ł±ź×¼×“æöĻĀ£¬5.6L NH3Óė×ćĮæCO2ĶźČ«·“Ӧɜ³ÉNH2CO2 NH4 (s)Ź±·Å³ö39.8kJµÄČČĮ棻¢ŚNH2CO2 NH4 (s)= CO(NH2)2(s)+ H2O(g) ”÷H=+72.5 KJ”¤mol-1£¬Ōņ2NH3(g)£«CO2(g)=CO(NH2)2(s)+ H2O(g)µÄ”÷H=_________KJ”¤mol-1”£
£Ø3£©ÓĆ(NH4)2CO3²¶Ģ¼µÄ·“Ó¦ČēĻĀ£ŗ(NH4)2CO3(aq)£«H2O(l)£«CO2(g)![]() 2(NH4)2HCO3(aq)”£ĪŖŃŠ¾æĪĀ¶Č¶Ō(NH4)2CO3²¶»ńCO2Š§ĀŹµÄÓ°Ļģ£¬½«Ņ»¶ØĮæµÄ(NH4)2CO3ČÜŅŗÖĆÓŚĆܱÕČŻĘ÷ÖŠ£¬²¢³äČėŅ»¶ØĮæµÄCO2ĘųĢ壬±£³ÖĘäĖü³õŹ¼ŹµŃéĢõ¼ž²»±ä£¬·Ö±šŌŚ²»Ķ¬ĪĀ¶ČĻĀ£¬¾¹żĻąĶ¬Ź±¼ä²āµĆCO2ĘųĢåÅØ¶Č£¬µĆµ½Ē÷ŹĘĶ¼£Ø¼ūĻĀĶ¼£©£ŗ
2(NH4)2HCO3(aq)”£ĪŖŃŠ¾æĪĀ¶Č¶Ō(NH4)2CO3²¶»ńCO2Š§ĀŹµÄÓ°Ļģ£¬½«Ņ»¶ØĮæµÄ(NH4)2CO3ČÜŅŗÖĆÓŚĆܱÕČŻĘ÷ÖŠ£¬²¢³äČėŅ»¶ØĮæµÄCO2ĘųĢ壬±£³ÖĘäĖü³õŹ¼ŹµŃéĢõ¼ž²»±ä£¬·Ö±šŌŚ²»Ķ¬ĪĀ¶ČĻĀ£¬¾¹żĻąĶ¬Ź±¼ä²āµĆCO2ĘųĢåÅØ¶Č£¬µĆµ½Ē÷ŹĘĶ¼£Ø¼ūĻĀĶ¼£©£ŗ

¢ŁcµćµÄÄę·“Ó¦ĖŁĀŹŗĶdµćµÄÕż·“Ó¦ĖŁĀŹµÄ“󊔹ŲĻµĪŖ£ÖÄęc ____£ÖÕżd £ØĢī”°£¾”±”¢”°£½”±»ņ”°£¼”±£©”£
¢Śb”¢c”¢dČżµćµÄĘ½ŗā³£ŹżK b”¢K c”¢Kd “ÓŠ”µ½“óµÄĖ³ŠņĪŖ_______£ØĢī”°£¾”±”¢”°£½”±»ņ”°£¼”±£©”£
¢ŪŌŚT2”«T4ĪĀ¶ČĒų¼ä£¬ČŻĘ÷ÄŚCO2ĘųĢåÅØ¶Č³ŹĻÖĻČ¼õŠ”ŗóŌö“óµÄ±ä»ÆĒ÷ŹĘ£¬ĘäŌŅņŹĒ______________”£
£Ø4£©ÓĆ¼īŠŌČÜŅŗŅ²æɲ¶Ģ¼£ŗŌŚ³£ĪĀĻĀ£¬½«0.04molCO2ĶØČė200mL0.2mol/LµÄNa2SČÜŅŗÖŠ£¬ŅŃÖŖ£ŗH2CO3µÄµēĄėĘ½ŗā³£Źż£ŗK1=4.3”Į10”Ŗ7”¢K2=5.6”Į10”Ŗ11£»H2SµÄµēĄėĘ½ŗā³£Źż£ŗK1=5.0”Į10”Ŗ8”¢K2=1.1”Į10”Ŗ12”£»Ų“šĻĀĮŠĪŹĢā£ŗ
¢Ł·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ___________”£
¢Ś³ä·Ö·“Ó¦ŗóĻĀĮŠ¹ŲĻµŹ½ÖŠÕżČ·µÄŹĒ ___________”£
A.c(Na+)>c(HCO3-)>c(HS-)>c(OH-)
B£®(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)
C£®c(CO32-)+ c(HCO3-)+ c(H2CO3)>c(H2S)+c(HS-)+c(S2-)
¢Ū¼ĘĖć·“Ó¦ŗóµÄČÜŅŗÖŠc(H2S)c(OH-)/ c(HS-)µÄÖµĪŖ___________ ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com