
 A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:分析 A、B、C、D为原子序数依次增大的四种元素,C、D为同周期元素,C核外电子总数是最外层电子数的3倍,则C为P元素;D元素最外层有一个未成对电子,D为Cl元素;A2-和B+具有相同的电子构型,则A为O元素、B为Na元素.
(1)四种元素电负性最大的为O元素,HF分子中存在着因氢键而形成的“缔合”分子;
(2)B为Na元素,检验方法为焰色反应,由于电子从能量较高的激发态跃迁到能量较低的激发态乃至基态时,以光的形式释放能量,呈现出不同的颜色;
(3)C和D反应可生成化合物为PCl3,为sp3杂化,根据价层电子对数和孤对电子对数判断构型;
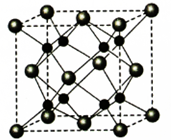
(4)A和B能够形成化合物F为离子化合物,阴离子位于晶胞的定点和面心,阳离子位于晶胞的体心,则Na的个数为8,O的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,
N(Na):N(O)=2:1,则形成的化合物为Na2O,计算质量和体积,可计算密度.
解答 解:A、B、C、D为原子序数依次增大的四种元素,C、D为同周期元素,C核外电子总数是最外层电子数的3倍,则C为P元素;D元素最外层有一个未成对电子,D为Cl元素;A2-和B+具有相同的电子构型,则A为O元素、B为Na元素.
(1)四种元素分别为O、Na、O、Cl,电负性最大的为O元素,HF分子中存在着因氢键而形成的“缔合”分子,使其相对分子质量偏大,
故答案为:O;HF分子中存在着因氢键而形成的“缔合”分子;
(2)B为Na元素,检验方法为焰色反应,由于电子从能量较高的激发态跃迁到能量较低的激发态乃至基态时,以光的形式释放能量,呈现出不同的颜色,
故答案为:焰色反应;电子从能量较高的激发态跃迁到能量较低的激发态乃至基态时,以光的形式释放能量;
(3)C和D反应可生成组成比为1:3的化合物为PCl3,P形成3个δ键,孤电子对数为$\frac{5-3×1}{2}$=1,则为sp3杂化,立体构型为为三角锥形,
故答案为:三角锥形;sp3;
(4)A和B能够形成化合物F为离子化合物,阴离子位于晶胞的顶点和面心,阳离子位于晶胞的体心,则Na的个数为8,O的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,
N(Na):N(O)=2:1,则形成的化合物为Na2O,晶胞中O位于顶点,Na位于体心,每个晶胞中有1个Na与O的距离最近,每个定点为8个晶胞共有,则晶胞中O原子的配位数为8,晶胞的质量为$\frac{4×62}{6.02×1{0}^{23}}$g,晶胞的体积为(0.566×10-7)cm3,则晶体F的密度为$\frac{4×62}{(0.566×1{0}^{-7})×6.02×1{0}^{23}}$g•cm-3=2.27 g•cm-3,
故答案为:Na2O;8;2.27g•cm-3.
点评 本题考查物质结构和性质,为高频考点,侧重考查学生空间想象能力、知识运用能力,涉及晶胞计算、原子结构等知识点,采用均摊法、价层电子对互斥理论等理论分析解答,难点是晶胞计算,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:解答题


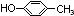 .
. .
.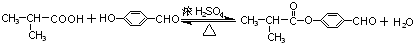 .
.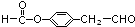 (邻、间、对任写一种即可).
(邻、间、对任写一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l),△H>-574 kJ•mol-1 | |
| B. | 反应①②转移的电子数不相同 | |
| C. | 若用标准状况下4.48L CH4 还原NO2至N2,放出的热量为173.4kJ | |
| D. | 若用标准状况下4.48L CH4 还原NO2至N2,整个过程中转移的电子总数为0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g O2 | B. | 0.2mol N2 | ||
| C. | 3.01×1023个CO2分子 | D. | 标准状况下11.2L H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,1mol任何气体物质的体积都约为22.4L | |
| B. | 1mol气体的体积约为22.4L | |
| C. | 标准状况下,1molO2和N2混合气(任意比)的体积约为22.4L | |
| D. | 任何条件下,气体的摩尔体积都是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
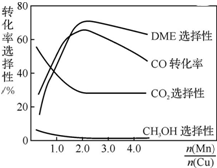 采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME).观察上右图回答问题:催化剂中$\frac{n(Mn)}{n(Cu)}$约为2.0时最有利于二甲醚的合成.
采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME).观察上右图回答问题:催化剂中$\frac{n(Mn)}{n(Cu)}$约为2.0时最有利于二甲醚的合成.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
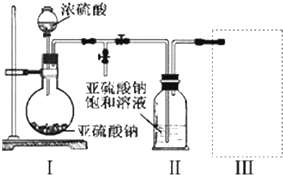
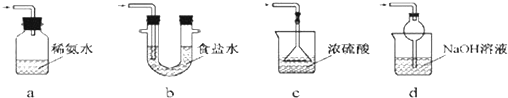

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 如图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构.实验测得金属钨的密度为19.30g•cm-3,钨的相对原子质量是183.9.假设金属钨原子为等径刚性球,试完成下列问题:
如图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构.实验测得金属钨的密度为19.30g•cm-3,钨的相对原子质量是183.9.假设金属钨原子为等径刚性球,试完成下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com