
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
| 处理前浓度/(mg•L-1) | 0.100 | 29.8 | 0.12 | 0.087 |
| 处理后浓度/(mg•L-1) | 0.004 | 22.6 | 0.04 | 0.053 |
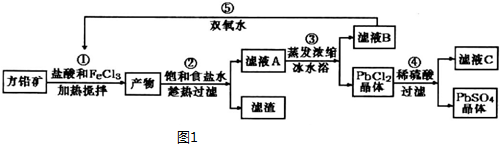
分析 往方铅矿中加入FeCl3溶液和盐酸,FeCl3与PbS反应生成PbCl2和S,产物中加入饱和食盐水,趁热过滤,利于PbCl2(s)+2Cl-(aq)?PbCl4-△H>0正向进行,使PbCl2溶解,过滤除去硫等杂质,滤液A含有PbCl4-、Cl-、Fe2+、Fe3+等,滤液A蒸发浓缩,冷水浴中冷却,利用平衡逆向进行,析出PbCl2晶体,滤液B中含有Fe2+、Fe3+,用过氧化氢进行氧化后循环利用,PbCl2晶体中加入稀硫酸,转化为更难溶的硫酸铅沉淀,过滤得到硫酸铅沉淀,洗涤、烘干得到硫酸铅粉末,滤液C中含有HCl.
(1)由Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7,分析加入盐酸的主要目的;
FeCl3与PbS反应生成PbCl2和S,Pb元素化合价不变,S元素化合价升高,则铁元素的化合价降低,有FeCl2生成;
(2)根据温度对平衡移动的影响进行分析;
(3)反应④的离子方程式为:PbCl2(s)+SO42-?PbSO4+2Cl-;
(4)过氧化氢将滤液B中Fe2+氧化为Fe3+,再循环利用,C溶液中含有HCl,也可以循环利用;
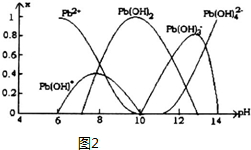
(5)①pH≥13时,Pb(OH)3-浓度减小,Pb(OH)42-浓度增大,Pb(OH)3-与氢氧根离子结合为Pb(OH)42-;
②Ⅰ.计算Pb2+、Fe3+的浓度转化率进行判断;
Ⅱ.参加反应的是Pb2+,由图象可知,选择PH要使铅全部以Pb2+形式存在.
解答 解:往方铅矿中加入FeCl3溶液和盐酸,FeCl3与PbS反应生成PbCl2和S,产物中加入饱和食盐水,趁热过滤,利于PbCl2(s)+2Cl-(aq)?PbCl4-△H>0正向进行,使PbCl2溶解,过滤除去硫等杂质,滤液A含有PbCl4-、Cl-、Fe2+、Fe3+等,滤液A蒸发浓缩,冷水浴中冷却,利用平衡逆向进行,析出PbCl2晶体,滤液B中含有Fe2+、Fe3+,用过氧化氢进行氧化后循环利用,PbCl2晶体中加入稀硫酸,转化为更难溶的硫酸铅沉淀,过滤得到硫酸铅沉淀,洗涤、烘干得到硫酸铅粉末,滤液C中含有HCl.
(1)Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7,流程中加入盐酸可以控制溶液的pH<1.9,主要目的是:抑制Fe3+的水解,
FeCl3与PbS反应生成PbCl2和S,Pb元素化合价不变,S元素化合价升高,则铁元素的化合价降低,有FeCl2生成,反应方程式为:2FeCl3+PbS=PbCl2+S+2FeCl2,反应离子方程式为:2Fe3++PbS=PbCl2+S+2Fe2+,
故答案为:抑制Fe3+的水解;2Fe3++PbS=PbCl2+S+2Fe2+;
(2)用冰水浴使PbCl2(s)+2Cl-(aq)?PbCl4-△H>0逆向移动,使PbCl4-转化PbCl2析出,
故答案为:用冰水浴使PbCl2(s)+2Cl-(aq)?PbCl4-△H>0逆向移动,使PbCl4-转化PbCl2析出;
(3)反应④的离子方程式为:PbCl2(s)+SO42-?PbSO4+2Cl-,平衡常数K=$\frac{{c}^{2}(C{l}^{-})}{c(S{{O}_{4}}^{2-})}$,
故答案为:$\frac{{c}^{2}(C{l}^{-})}{c(S{{O}_{4}}^{2-})}$;
(4)过氧化氢将滤液B中Fe2+氧化为Fe3+,再循环利用,C溶液中含有HCl,也可以循环利用,
故答案为:FeCl3、HCl;
(5)①pH≥13时,Pb(OH)3-浓度减小,Pb(OH)42-浓度增大,Pb(OH)3-与氢氧根离子结合为Pb(OH)42-,反应离子方程式为:Pb(OH)3-+HO-=Pb(OH)42-,
故答案为:Pb(OH)3-+HO-=Pb(OH)42-;
②Ⅰ.加入试剂,Pb2+的浓度转化率为$\frac{(0.1-0.004)}{0.1}$×1005%=96%,Fe3+的浓度转化率为$\frac{0.12-0.04}{0.12}$×100%=67%,所以去除Pb2+比Fe3+效果好,
故答案为:加入试剂,Pb2+的浓度转化率为$\frac{(0.1-0.004)}{0.1}$×1005%=96%,Fe3+的浓度转化率为$\frac{0.12-0.04}{0.12}$×100%=67%,所以去除Pb2+比Fe3+效果好;
Ⅱ.反应为2EH(s)+Pb2+?E2Pb(s)+2H+,参加反应的是Pb2+,由图象可知,选择PH要使铅全部以Pb2+形式存在,则脱铅时最合适的pH约6,
故答案为:6.
点评 本题考查物质制备实验方案,正确理解制备工艺流程为解答关键,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力,难度中等.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | HF | Ka=6.8×10-4 mol•L-1 |
| ② | CH3COOH | Ka=1.7×10-5 mol•L-1 |
| ③ | HCN | Ka=6.2×10-10 mol•L-1 |
| ④ | H2CO3 | Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
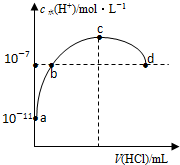
| A. | b、d两点为恰好完全反应点 | |
| B. | c点溶液中c(NH4+)=c(Cl-) | |
| C. | a、b之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-) | |
| D. | 常温下,0.1mol/L氨水的电离常数K约为1×10-5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
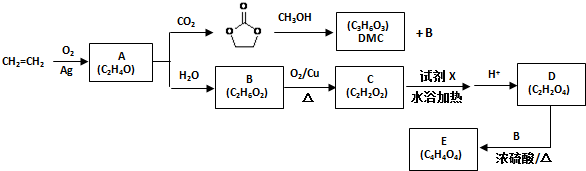
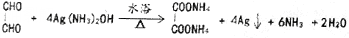 .
.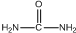 )和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式
)和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式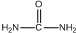 +2CH3OH$→_{△}^{催化剂}$
+2CH3OH$→_{△}^{催化剂}$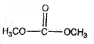 +2NH3↑.
+2NH3↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
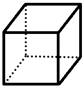 “立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示.
“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com