
| A、n(H2SO4)=0.6mol c(H2SO4)>6mol/L |
| B、n(H2SO4)=0.3mol c(H2SO4)≥3mol/L |
| C、n(H2SO4)<0.3mol c(H2SO4)<3mol/L |
| D、0.3mol≤n(H2SO4)≤0.6mol 3mol/L≤c(H2SO4)≤6mol/L |


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
| 物质编号 | 物质转化关系 | a | b | c | d |
| ① | 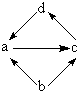 | FeCl2 | Fe | FeCl3 | CuCl2 |
| ② | Na2O | Na | Na2O2 | Mg(OH)2 | |
| ③ | NO | N2 | NO2 | NaCl | |
| ④ | Al2O3 | Al | Na[Al(OH)4] | Al(OH)3 |
| A、①②③ | B、①③④ |
| C、①④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y的简单离子半径小于Z的简单离子半径 |
| B、Z最高价氧化物对应的水化物分别与X、Y最高价氧化物对应的水化物反应生成1mol水时所放出的热量相同 |
| C、Y的简单气态氢化物在一定条件下可被Q单质氧化 |
| D、Q可分别与X、Y、Z、W形成化学键类型相同的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 1 | 2 | 3 | 4 |
| 模型示意图 |  |  |  |  |
| A、模型1对应的物质的二氯代物有2种 |
| B、模型2对应的物质的官能团是羧基 |
| C、模型2对应的物质与模型3对应的物质能发生酯化反应 |
| D、模型4对应的物质可以与氯气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不能用氯气消毒后的自来水配制FeCl2溶液 |
| B、过氧化钠与水的反应中水既不作氧化剂也不作还原剂 |
| C、等质量的钠投入到足量水中和将钠用铝箔包好并刺一些小孔再放人足量的水中生成氢气一样多 |
| D、铁制品要防锈而铝制品却不要防锈,这是由于铝表面易形成一层致密的氧化膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com