
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ②③④ |
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | Li、Na、K元素原子的核外电子层数随着核电荷数的增加而增多 | |
| B. | 第二周期元素从Li到F,非金属性逐渐增强 | |
| C. | 因为Na比K容易失电子,所以Na比K的还原性强 | |
| D. | F与Cl为同主族的元素,且F比Cl的非金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
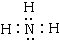 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用NH4Cl与NaNO2溶液混合微热制N2 | |
| B. | SnCl4与水的反应:SnCl4+2H2O═SnO2+4HCl | |
| C. | 人工树叶制取甲烷:CO2+2H2O$\frac{\underline{\;\;\;\;\;\;\;光\;\;\;\;\;\;\;}}{人工树叶}$CH4+2O2 | |
| D. | 银针验毒:4Ag+2H2S+O2═2Ag2S+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 应用李比希法、钠熔法、铜丝燃烧法、元素分析仪都可确定有机化合物的元素组成 | |
| B. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物组成元素和结构的分析 | |
| C. | 运用同位素示踪法可确定有机物的反应机理 | |
| D. | 可用酸性高锰酸钾溶液或溴水鉴定某有机物分子中是否含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com