
分析 先根据n=$\frac{m}{M}$计算出水的物质的量,分子数相同时二者的物质的量相等,然后根据m=nM计算出需要磷酸的物质的量;最后根据N=NA计算出含有O原子的物质的量.
解答 解:4.5g水的物质的量为:n(H2O)=$\frac{4.5g}{18g/mol}$=0.25mol,与磷酸的分子数相同,则物质的量相同,则n(H3PO4)=0.25mol,m(H3PO4)=0.25mol×98g/mol=24.5g;
它们所含氧原子数之比是(0.25mol):(4×0.25mol)=1:4,
故答案为:24.5;1:4.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、阿伏伽德罗常数之间的关系即可解答,试题侧重基础知识的考查,有利于提高学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | SO2+2H2S═S+2H2O | B. | 2NaNO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaNO2+O2↑ | ||
| C. | NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O | D. | 3Cl2+6KOH═5KCl+KClO3+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
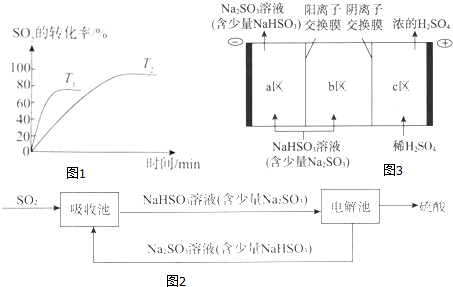
| 投料比 | a | b | c | d |
| SO2平衡转化率/% | 97.1 | 96.8 | 95.8 | 90.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
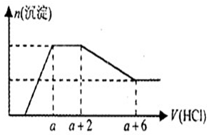 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )| A. | 原溶液中一定含有Na2SO4 | |
| B. | 反应后形成的溶液溶质为NaCl | |
| C. | 原溶液中含有CO32-与AlO2-的物质的量比为1:1 | |
| D. | 原溶液中一定含有的离子是OH-,CO32-,SiO32-,AlO2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com