
| A. | 乙烯 | B. | 丙烯 | C. | 2-甲基丙烯 | D. | 2-丁烯 |
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三月考二化学试卷(解析版) 题型:选择题
下列说法正确的是
A.甲烷、汽油、生物柴油、酒精都是碳氢化合物,都可作燃料
B.可食用植物油含有的高级脂肪酸甘油酯是人体的营养物质
C.钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高
D.用CuSO4溶液使蛋清溶液发生盐析,进而提纯分离蛋白质
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上10月月考化学试卷(解析版) 题型:选择题
下列食品添加剂中,其使用目的与反应速率有关的是
A.抗氧化剂 B.调味剂 C.着色剂 D.增稠剂
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上期中化学试卷(解析版) 题型:选择题
VL硫酸铁溶液中含Fe3+ 的质量为mg ,则此溶液中SO42- 的物质的量浓度为
A. B.
B. C.
C. D.
D.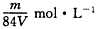
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| w(CaO)% NaOH浓度& 浸出率% 碱用量c/mol•L-1 | 0.1 | 1.3 | 1.3 | 2.7 |
| 30 | 30 | 40 | 40 | |
| 1.1 | 99.1 | 90.1 | 93.3 | 83.2 |
| 1.3 | 99.4 | 92.7 | 93.0 | 82.1 |
| 1.5 | 99.5 | 93.4 | 96.5 | 83.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com