
| A. | H+ Na+ S2- CO32- | B. | H+ Ca2+ MnO4- NO3- | ||
| C. | K+ Ca2+ Cl- HCO3- | D. | Cl- Mg2+ Al3+ SO42- |
分析 根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,并结合加适量NaOH溶液有沉淀生成,滴加盐酸有气泡放出及离子的颜色来解答.
解答 解:A.H+分别与S2-、CO32-反应,不能大量共存,故A不选;
B.该组离子之间不反应,可大量共存,但MnO4-为紫色,与无色不符,故B不选;
C.该组离子之间不反应,可大量共存,加适量NaOH溶液有碳酸钙沉淀生成,滴加盐酸有二氧化碳放出,离子均为无色,故C选;
D.该组离子之间不反应,可大量共存,但加盐酸不生成气体,故D不选;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.


 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:填空题
| 物质 | C(s) | H2(g) | C2H4(g) | C2H6(g) | C3H8(g) | C12H26(l) |
| △H/ kJ•mol-1 | -393.5 | -285.8 | -1 411.0 | -1 559.8 | -2 219.9 | -8 571.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若恒容下,充入氮气,则c(SO3)小于0.04mol•L-1 | |
| B. | 该条件下反应的平衡常数为1.6×103 | |
| C. | v(O2)=0.02 mol•L-1.min-1 | |
| D. | 使用催化剂若平衡没有移动,则该反应达到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇既是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇既是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
| B | 冰醋酸 | 漂白粉 | 硫酸钡 | 二氧化硫 |
| C | 石墨 | 空气 | 苛性钾 | 碳酸钙 |
| D | 浓硫酸 | 氨水 | 氯化钠 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
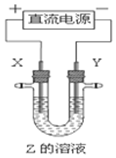 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )| A. | 氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 电镀工业中,X是待镀金属,Y是镀层金属 | |
| D. | 外加电流的阴极保护法中,Y是待保护金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组别 | ① | ② | ③ | ④ |
| V[FeCl3(aq)]/mL | 50 | 50 | 50 | 50 |
| 混合粉末质量/g | 1.2 | 2.4 | 3.6 | 4.8 |
| 反应后剩余固体质量/g | 0 | 0.64 | 1.92 | 3.12[ |
| A. | 第①组反应后溶液中剩余c(Fe3+)=0.4 mol•L-1 | |
| B. | 第②、③组剩余固体全是铜 | |
| C. | 第④组的滤液中c(Fe2+)=2.0 mol•L-1 | |
| D. | 原混合粉末中n(Fe):n(Cu)=1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com