
| 序号 | 元素 | 结构及性质 |
| ① | A | A单质是生活中常见金属,它有两种常见氯化物,相对分子质量相差35.5 |
| ② | B | B原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| ③ | C | C是常见化肥的主要元素,单质常温下呈气态 |
| ④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ⑤ | E | 通常情况下,E没有最高正化合价,A、B、C、D、F都能与E形成化合物 |
| ⑥ | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |


分析 A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5,说明其A具有变价,则A为Fe元素;B原子最外层电子数是内层电子总数的$\frac{1}{5}$,原子只能有3个电子层,最外层电子数为2,故B为Mg元素;C是常见化肥的主要元素,单质常温下呈气态,则C为N元素;D单质被誉为“信息革命的催化剂”,是常用的半导体材料,D为Si;F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族,则F为H元素;通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物,则E为O元素,据此解答.
解答 解:A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5,则A为Fe;B原子最外层电子数是内层电子总数的$\frac{1}{5}$,原子只能有3个电子层,最外层电子数为2,故B为Mg元素;C是常见化肥的主要元素,单质常温下呈气态,则C为N元素;D单质被誉为“信息革命的催化剂”,是常用的半导体材料,D为Si;F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族,则F为H元素;通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物,则E为O元素,
(1)A为Fe元素,在周期表中的位置为:第四周期Ⅷ族,
故答案为:第四周期Ⅷ族;
(2)B与C形成的化合物的化学式为Mg3N2,Mg3N2为离子化合物,其电子式为 ,
,
故答案为:Mg3N2; ;
;
(3))①C与F分别为N、H元素,二者组成的5核阳离子为铵根离子,能使湿润的红色石蕊试纸变蓝色的气体是氨气,先加入浓氢氧化钠溶液将铵根离子转化为氨气,然后再用湿润的红色石蕊试纸检验氨气,
故答案为:加入浓NaOH溶液加热,生成气体若能够使湿润的红色石蕊试纸变蓝,说明含有铵根离子;
②N、H组成18电子化合物为N2H4,是共价化合物,氮原子和氢原子形成共价键,氮原子和氮原子间也形成共价键,其结构式为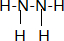 ,
,
故答案为: ;
;
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱:4NH3+3O2(纯)$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O,
故答案为:4NH3+3O2(纯)$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O;
(5)碳能与二氧化硅反应生成硅单质,工业制备Si的粗产品的化学反应方程式为:SiO2+2C═Si+2CO↑,
故答案为:SiO2+2C═Si+2CO↑.
点评 本题考查位置结构与性质关系的应用,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题有利于提高学生的分析、理解能力及逻辑推理能力.


科目:高中化学 来源: 题型:解答题
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题


| 滴定次数 | FeSO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | |
| 第一次 | 0.50 | 23.60 |
| 第二次 | 1.00 | 26.30 |
| 第三次 | 1.20 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
 ;B和C的离子中,半径较小的是Na+(填离子符号 );五种原子中半径最大的是Na(填元素符号 ).五种元素最高价氧化物的水化物酸性最强的是(以上填化学式)HClO4.
;B和C的离子中,半径较小的是Na+(填离子符号 );五种原子中半径最大的是Na(填元素符号 ).五种元素最高价氧化物的水化物酸性最强的是(以上填化学式)HClO4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若可以水解,且能发生银镜反应,则其同分异构有8种 | |
| B. | 若可以与碳酸氢钠溶液反应生成CO2,则其同分异构有8种 | |
| C. | 一定能与Na反应生成H2 | |
| D. | 可能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:填空题
X、Y、Z、Q、W、R六种短周期元素原子序数依次增大。化合物甲由X、Z、Q三种元素组成,常温下0.1mol/L甲溶液的pH=13。工业上常用电解饱和QR溶液生成甲;化合物乙由X、R两种元素组成。请回答下列问题:
(1)Q的离子结构示意图为____________。
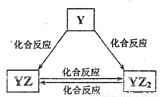
(2)Y元素的单质能发生如图所示的转化,请写出图中反应YZ2→YZ的化学方程式:___________(注明反应条件)。在甲溶液中通入足量YZ2气体,所得溶液呈碱性,写出该溶液中的阴离子浓度由大到小的顺序:______________。
(3)W的单质既能与甲溶液反应,又能与乙溶液反应。
① 常温下,将W的单质和甲溶液混合,发生反应的离子方程式为____________;
② Q、W金属性的强弱为Q>W,下列表述中正确的且能证明这一事实的是__________(填序号)
a. Q单质的熔点比W单质的低
b. W单质的硬度比Q大
c. Q单质能将W从它的盐溶液中置换出来
d. Q的最高价氧化物的水化物的碱性比W的最高价氧化物的水化物的碱性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com