
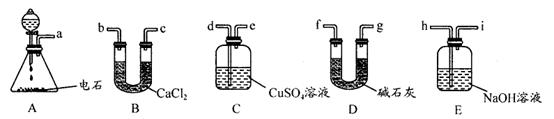
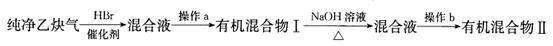


科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
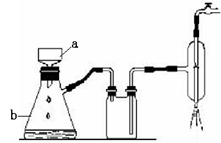
科目:高中化学 来源:不详 题型:实验题
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8[ | 83.8 | 114 |
 2Fe2++I2,有资料认为这可能是一个可逆反应。Fe3+与I-反应后的溶液显深红色,它是I2溶于KI溶液的颜色。为探究该深红色溶液中是否含Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写位于答题卷的下表。0.1 mol/L的FeCl3、KI、KSCN、NaOH、H2SO4、KMnO4溶液,CCl4,蒸馏水。
2Fe2++I2,有资料认为这可能是一个可逆反应。Fe3+与I-反应后的溶液显深红色,它是I2溶于KI溶液的颜色。为探究该深红色溶液中是否含Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写位于答题卷的下表。0.1 mol/L的FeCl3、KI、KSCN、NaOH、H2SO4、KMnO4溶液,CCl4,蒸馏水。| 编号 | 实验操作 | 预期现象和结论 |
| ① | 在试管中加入少量FeCl3溶液和 (填少量、过量)的KI溶液。 | 深红色如期出现 |
| ② | 将试管中的混合溶液转移至 (填仪器)中,倒入一定量的 , 。 | |
| ③ | | |
查看答案和解析>>
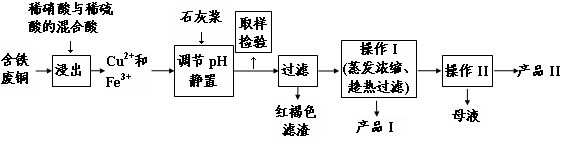
科目:高中化学 来源:不详 题型:实验题
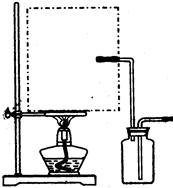
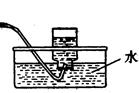


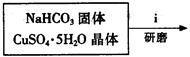
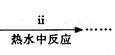
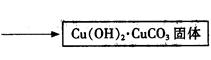
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Cl2↑+MnCl2+2H2O。
Cl2↑+MnCl2+2H2O。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
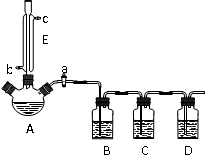
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
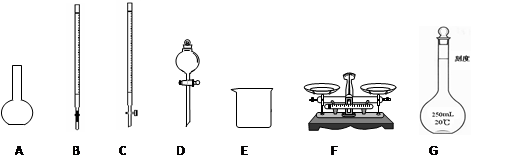
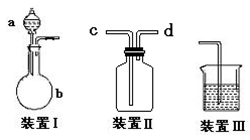
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cl2的尾气,可用NaOH溶液吸收 |
| B.NH3的尾气,可用H2SO4溶液吸收 |
| C.SO2的尾气,可用酸性KMnO4溶液吸收 |
| D.NO2的尾气,可用H2O来吸收 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com