
【题目】烃A是一种重要的化工原料,已知A在标准状况下的密度为1.25g·L-1,D是塑料的主要成分,据此回答下列有关问题:

(1)A的结构简式为__________。
(2)反应⑤的反应类型为__________。
(3)反应⑥的方程式为__________。
(4)下列说法不正确的是__________。
A.通过石蜡油的裂化可以得到多种A的同系物,如丙烯
B.反应⑨的条件是氯气、光照
C.反应⑦的反应类型为消去反应
D.反应④为加聚反应,得到的产物可使酸性高锰酸钾溶液褪色
E.得到C有多种途径,通过途径⑧⑨得到C,产率较低
【答案】CH2=CH2 消去反应 CH3CH2Cl+NaOH![]() NaCl+CH3CH2OH AD
NaCl+CH3CH2OH AD
【解析】
A在标准状况下的密度为1.25gL-1,A的摩尔质量为1.25g/L×22.4L/mol=28g/mol,由合成流程可知,A为CH2=CH2,A与H2O反应生成B,B为CH3CH2OH,A与HCl反应生成C,C为CH3CH2Cl,D是塑料的主要成分,D为聚乙烯,A与氢气反应生成E,E为CH3CH3,以此来解答。
(1)由上述分析可知,A为CH2=CH2,故答案为:CH2=CH2。
(2)第⑤步反应由CH3CH2Cl生成CH2=CH2,CH3CH2Cl在醇/加热条件下与氢氧化钠发生消去反应生成乙烯,故答案为:消去反应。
(3)氯乙烷和氢氧化钠溶液加热发生取代反应生成乙醇和氯化钠,反应的化学方程式为CH3CH2Cl+NaOH![]() NaCl+CH3CH2OH,故答案为:CH3CH2Cl+NaOH
NaCl+CH3CH2OH,故答案为:CH3CH2Cl+NaOH![]() NaCl+CH3CH2OH。
NaCl+CH3CH2OH。
(4)
A.石蜡油中含大分子烃,裂解是工业上大量获得乙烯、丙烯等气态短链烃的主要方法,故A错误;
B.反应⑨是乙烷发生取代反应生成氯乙烷,属于取代反应,取代反应的条件是氯气、光照,故B正确;
C.反应⑦是乙醇发生消去反应生成乙烯,故C正确;
D.反应④是乙烯发生加聚反应生成聚乙烯,属于加聚反应,聚乙烯中不含有碳碳双键,不能使酸性高锰酸钾溶液褪色,故D错误;
E.由图可知,生成氯乙烷的途径有②、⑧⑨两种途径,其中途径⑧⑨是通过乙烷生成氯乙烷,除了氯乙烷,还会生成二氯乙烷、三氯乙烷、四氯乙烷、五氯乙烷、六氯乙烷等产物,产率较低,故E正确。
故答案为:AD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】CoCO3是一种制造锂电池电极的原料。以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、 ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
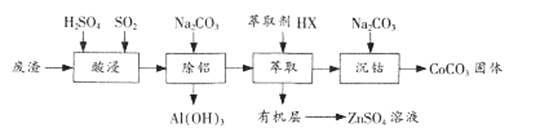
①相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)

②钴元素常见的化合价为+2、+3,+2钴有较强的还原性。
③+3钴的化合物一般呈现粉红—红色。
④Ksp[Co(OH)2]=1.58×10-15 Ksp[CoCO3]=1.4×10-13
(1)“酸浸”时通人SO2的目的是 ___________。
(2)“除铝”时调节溶液pH范围为 ________,该过程中主要反应的离子方程式为___________________。
(3)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 ___________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 ___________________。
(4)“沉钴”时Na2CO3溶液需缓慢滴加的原因是 ____________________。
(5)CoCO3隔绝空气灼烧可以生成Co2O3,该反应的化学方程式为____________________。
(6)在CoCO3中先加入几滴丙酮,再边振荡边逐滴加入浓氨水,沉淀逐渐由粉红色变为土黄色的含Co(NH3)6 2+的溶液,向溶液中缓缓通入一定量的氧气,溶液最终变为红色。
①加入丙酮的作用__________________________;②若在该红色溶液中滴加足量的浓盐酸生成标准状况下2.24L C12,则之前往土黄色的溶液中至少应通入标准状况下__________________________升空气(空气中氧气体积分数为0.20)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬(Ⅵ)的化合物有较大毒性,如不回收利用,会对环境造成污染。某混合浆液含Al(OH)3、MnO2和少量Na2CrO4。某研究小组设计了如下电解分离装置,可以使浆液较完全地分离成固体混合物和含铬元素溶液,并回收利用。下列说法错误的是( )
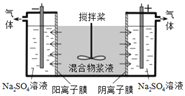
A. 通电后CrO42-将通过阴离子膜进入阳极室 B. 阴极室最终只能得到Na2SO4和H2
C. 阳极的电极反应式为:4OH--4e-=O2↑+2H2O D. 分离后所得含铬元素的粒子有CrO42-和Cr2O72-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用如图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。请回答下列问题:
![]()
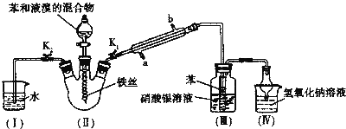
(1)冷凝管所起的作用为冷凝回流和导气,冷凝水从______口进入(填“a或“b”)。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。 Ⅲ中小试管内苯的作用是_____。能说明苯与液溴发生了取代反应的现象是_____。Ⅳ中球形干燥管的作用是_____。
(3)待三颈烧瓶中的反应进行到仍有气泡冒出时,关闭分液漏斗活塞,再_____,这样操作的目的是_____。(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中有0.2mol XO4﹣ , 加入0.3mol Na2SO3恰好反应,已知Na2SO3被氧化成Na2SO4 , 则还原产物中X的化合价为( )
A.0
B.+1
C.+3
D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是

A. x=2.24
B. 铝的物质的量为0.2 mol
C. 反应时,Na、Mg、Al均过量
D. 曲线b为Mg与盐酸反应的图像
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
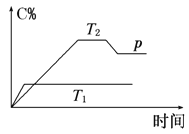
(1)温度T1________T2(填“大于”“等于”或“小于”)。
(2)正反应是________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m________2(填“大于”“等于”或“小于”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡___ _____移动(填“向正反应方向”“向逆反应方向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式或离子共存的叙述正确的是
A. 用肥皂(主要成份C17H35COONa)水检验含有较多钙离子的硬水:2C17H35COO-+Ca2+===(C17H35COO)2Ca↓
B. 将磁性氧化铁溶于氢碘酸:Fe3O4+8H+=2Fe3++Fe2++4H2O
C. 常温下,在![]() =0.1的溶液中:Na+、K+、SO42-、HCO3-能大量共存
=0.1的溶液中:Na+、K+、SO42-、HCO3-能大量共存
D. 在NaC1O溶液中:SO32-、OH-、C1-、K+能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
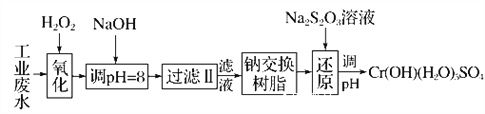
注:常温下,部分阳离子以氢氧化物形式完全沉淀时所需的pH,如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9 |
(1)氧化过程中可代替H2O2加入的试剂是________(填字母,下同)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;
已知钠离子交换树脂的原理:Mn++nNaR―→MRn+nNa+,此步操作被交换除去的杂质离子是____________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程在酸性条件下进行,每消耗0.8 mol Cr2O![]() 转移4.8 mol e-,该反应离子方程式为________________________________________________________________________。
转移4.8 mol e-,该反应离子方程式为________________________________________________________________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O![]() 形式存在,工业上常用电解法处理含Cr2O
形式存在,工业上常用电解法处理含Cr2O![]() 的废水,该法用Fe作电极电解含Cr2O
的废水,该法用Fe作电极电解含Cr2O![]() 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
(1)电解时能否用Cu电极来代替Fe电极?________(填“能”或“不能”),理由是_____________。
(2)常温下,Cr(OH)3的溶度积Ksp=1×10-20,假设溶液的c(Cr3+)=0.01mol/L,当pH应为______时开始生成沉淀。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com