
某温度下,反应SO2(g)+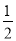 O2(g)
O2(g) SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g)
SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g) 2SO2(g)+O2(g)的平衡常数K2的值为
2SO2(g)+O2(g)的平衡常数K2的值为
A.2500 B.100 C.4×10-4 D.2×10-2
科目:高中化学 来源:2014-2015福建省等四校高一上学期期中联考化学试卷(解析版) 题型:选择题
下列叙述中不正确的是
A.“氯碱工业”通过电解饱和食盐水生产氯气和烧碱。
B.通常状况下,干燥的氯气能和Fe反应
C.纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状;光照H2和Cl2的混合气体时,因迅速化合而爆炸
D.新制氯水具有漂白性,久置氯水最终变为稀盐酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三12月月考理综化学试卷(解析版) 题型:实验题
(10+2分)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。利用下图所示装置进行实验。

(1)装置①的作用是 装置③的作用是 。
(2)装置②中产生ClO2气体的化学方程式为 。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;
②趁热过滤;
③ ;
④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c mol?L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省等七校高三12月联考理综化学试卷(解析版) 题型:选择题
MOH和ROH两种一元碱,其水溶液分别加水稀释时,pH变化如下图所示。下列叙述中正确的是
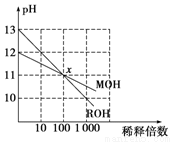
A.在x点时,ROH完全电离 B.在x点时,c(M+)>c(R+)
C.MOH是一种强碱 D.稀释前,c(ROH)=10c(MOH)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴市高二10月月考化学试卷(解析版) 题型:填空题
现有反应aA(g)+bB(g)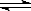 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是_______热反应,且a+b______p(填“>”“<”或“=”)。
(2)减压时,A的质量分数________(填“增大”“减小”或“不变”,下同),正反应速率________。
(3)若加入B(体积不变),则A的转化率________,B的转化率________。
(4)若升高温度,则平衡时,B、C的浓度之比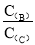 将________。
将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量________。
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色________,而维持容器体积不变,充入氖气时,混合物的颜色________(填“变浅”“变深”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴市高二10月月考化学试卷(解析版) 题型:选择题
密闭容器中,反应xA(g)+yB(g)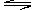 zC(g),达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的两倍,达到平衡时A的浓度降为0.3mol/L。下列判断正确的是
zC(g),达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的两倍,达到平衡时A的浓度降为0.3mol/L。下列判断正确的是
A.x+y<z B.平衡向正反应方向移动
C.B的转化率降低 D.C的体积分数增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴市高二10月月考化学试卷(解析版) 题型:选择题
下列热化学方程式或说法正确的是
A.甲烷的燃烧热为ΔH=-890 kJ·mol-1 ,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890 kJ· mol-1
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)  2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C.已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ·mol-1 ,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
D.在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链。其主要工艺如下:
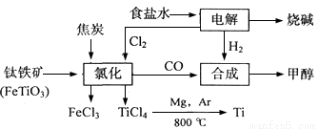
(1)写出电解食盐水反应的离子方程式 。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式: 。
(3)已知:①Mg(s) +Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH
反应2Mg+TiCl4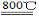 2MgCl4+Ti在Ar气氛中进行的理由是 。
2MgCl4+Ti在Ar气氛中进行的理由是 。
(4)在上述产业链中,合成192 t甲醇理论上需额外补充H2 t(不考虑生产过程中物质的任何损失)。
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:填空题
(10分)科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是 。(选填字母)
A.电解水 B.锌和稀硫酸反应
C.光解海水 D.分解天然气
(2)用水分解获得氢气的能量变化如图所示,表示使用催化剂是曲线 。该反应为 (放热还是吸热)反应。

(3)1g的氢气完全燃烧生成液态水释放出142.9kJ的热量.写出其完全燃烧的热化学方程式: 。
(4)氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图所示实验:
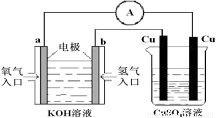
上图装置中,某一铜电极的质量减轻 6.4g ,则 a 极上消耗的O2在标准状况下的体积为 L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com