
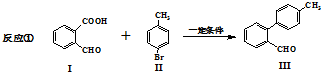
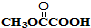 与
与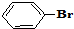 也可以发生类似反应①的反应,有机产物的结构简式为
也可以发生类似反应①的反应,有机产物的结构简式为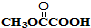 与
与 发生取代反应,-Br、-COOH均被取代.
发生取代反应,-Br、-COOH均被取代.| 6 |
| 4 |
| 3 |
| 2 |
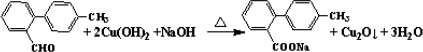 ,
,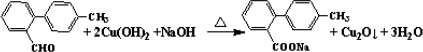 ;
;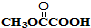 与
与 发生取代反应,-Br、-COOH均被取代,有机产物的结构简式为
发生取代反应,-Br、-COOH均被取代,有机产物的结构简式为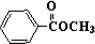 ,故答案为:
,故答案为: .
.


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
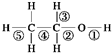
| A、乙醇和钠反应,键①断裂 |
| B、在Ag催化下和O2反应,键①③断裂 |
| C、乙醇和浓H2SO4共热140℃时,键①或键②断裂;在170℃时,键②⑤断裂 |
| D、乙醇完全燃烧时断裂键①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
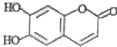 ,下列叙述不正确的是( )
,下列叙述不正确的是( )| A、该物质在酸性条件下加热可以水解 |
| B、1mol M最多能与3mol Br2发生反应 |
| C、M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |
| D、1mol M与足量NaHCO3反应能生成2mol CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a原子的最外层电子数比B原子的最外层电子数少 |
| B、a原子电子层数比b原子的电子层数多 |
| C、1mol a从酸中置换H+生成的H2比b从酸中置换H+生成的H2要容易 |
| D、常温时,b能从水中置换出氢,而a不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
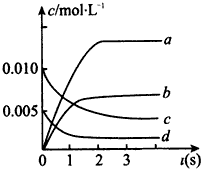 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表所示
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表所示
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:
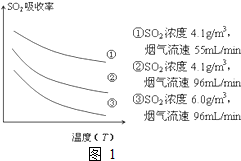 火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.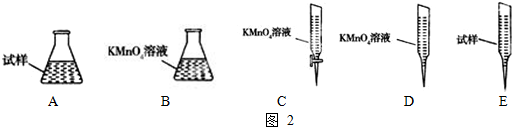
| 滴定次数 | 待测溶液 的体积/mL |
标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | ① | ② | ③ |
| 压强/Pa | 1×105 | 2×105 | 1×106 |
| c(A)mol?L-1 | 0.08 | 0.16 | 0.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA |
| B、将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积约为22.4L |
| C、在反应KClO4+8HCl═KCl+4Cl2↑+4H2O中,每生成4mol Cl2转移的电子数为8NA |
| D、25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com