

���� ��1��Ag2O���к����CuCl�������ֽⷴӦ�������������ɷ�������������ֻ����
��2���ٸ���ͼ֪�������õ����������������ӡ�Cuʧ��������ͭ���ӣ�����������ʴ����Cu��������
��Cl-��ɢ���ڣ�����������Ӧ���������Ӧ�����������ɶ��״��Cu2��OH��3Cl������������ͭ���ӡ��������������������ӣ����Ը����ӷ�ӦΪ�����ӡ�ͭ���Ӻ����������ӷ�Ӧ����Cu2��OH��3Cl������
��n[Cu2��OH��3Cl]=$\frac{4.29g}{214.5g/mol}$=0.02mol������ת�Ƶ��Ӽ����������ʵ������ٸ���V=nVm���������
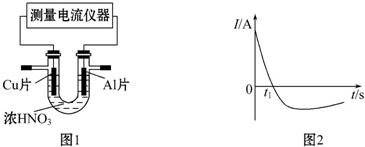
��3���������⣬0��t1ʱ��ԭ��صĸ�����AlƬ�����к���ɫ���������˵����Һ�е�������������ŵ磬�ݴ˽�ɣ����������ı䣬��ԭ��ص������������ı䣬�ݴ˷���ԭ�ɣ�
��� �⣺��1��Ag2O���к����CuCl�������ֽⷴӦ�������������ɷ�������������ֻ������Ӧ����ʽΪAg2O+2CuCl=2AgCl+Cu2O��
�ʴ�Ϊ��Ag2O+2CuCl=2AgCl+Cu2O��
��2���ٸ���ͼ֪�������õ����������������ӡ�Cuʧ��������ͭ���ӣ�����������ʴ����Cu����������c�Ǹ������ʴ�Ϊ��c��
��Cl-��ɢ���ڣ�����������Ӧ���������Ӧ�����������ɶ��״��Cu2��OH��3Cl������������ͭ���ӡ��������������������ӣ����Ը����ӷ�ӦΪ�����ӡ�ͭ���Ӻ����������ӷ�Ӧ����Cu2��OH��3Cl���������ӷ���ʽΪ2Cu2++3OH-+Cl-=Cu2��OH��3Cl����
�ʴ�Ϊ��2Cu2++3OH-+Cl-=Cu2��OH��3Cl����
��n[Cu2��OH��3Cl]=$\frac{4.29g}{214.5g/mol}$=0.02mol������ת�Ƶ��ӵ�n��O2��=$\frac{0.02mol��2��2}{4}$=0.02mol��V��O2��=0.02mol��22.4L/mol=0.448L��
�ʴ�Ϊ��0.448��
��3��0��t1ʱ��ԭ��صĸ�����AlƬ����Һ�в�������ɫ�����Ƕ�����������������Ӧ����ʽΪ��2H++NO3-+e-=NO2��+H2O����ʱ��Һ�е�����������������һ��ʱ�������Al��Ũ���ᷢ���ۻ�������ԭ�����Al��������Cu��������
�ʴ�Ϊ��2H++e-+NO3-=NO2��+H2O����������Ũ�����з����ۻ�����������������Ĥ��ֹ��Al�Ľ�һ����Ӧ��
���� ���⿼����ۺϣ����ؿ���ѧ�������ۺ�Ӧ�ü������������漰������ԭ��Ӧ���㡢���ӷ���ʽ�����ֽⷴӦ����ʽ����д��ԭ���ԭ����֪ʶ�㣬����ԭ���ԭ�����������ʼ�ת�Ƶ����غ���н����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ȡ10mL�ܶ�1.20g/cm3����������36.5%��y���ᣬ��ˮϡ����300mL����ϡ�ͺ���������ʵ���Ũ����0.4mol/L��
��ȡ10mL�ܶ�1.20g/cm3����������36.5%��y���ᣬ��ˮϡ����300mL����ϡ�ͺ���������ʵ���Ũ����0.4mol/L���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �ڹ�̬��������������У����µ��H2O-CO2��������Ʊ�H2��CO��һ���µ���Դ���÷�ʽ������ԭ����ͼ��ʾ������˵������ȷ���ǣ�������
�ڹ�̬��������������У����µ��H2O-CO2��������Ʊ�H2��CO��һ���µ���Դ���÷�ʽ������ԭ����ͼ��ʾ������˵������ȷ���ǣ�������| A�� | X�ǵ�Դ�ĸ��� | |
| B�� | �������������ɵ���������ʵ���֮����1��1 | |
| C�� | �ܷ�Ӧ�ɱ�ʾΪ��H2O+CO2$\frac{\underline{\;ͨ��\;}}{\;}$H2+CO+O2 | |
| D�� | �����ķ�Ӧʽ�ǣ�H2O+2e-�TH2+O2�� CO2+2e-�TCO+O2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 10g H2��10g N2 | B�� | 22gCO2��3.01��1023��O2 | ||
| C�� | 3.2g O2��2.24L�Ŀ��� | D�� | 1mol H2O��1g H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2��3 | B�� | 1��4 | C�� | 3��4 | D�� | 3��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ķ�ɢ��������ֽ | |
| B�� | �����ܲ������������ | |
| C�� | �����Ǵ����������ɢϵ�ǻ���� | |
| D�� | ����ķ�ɢ������ֱ����10-7��10-9m֮�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ȼ���������ˮ | B�� | �Ȼ��Ƶ�ˮ��Һ�ܵ��� | ||
| C�� | ����״̬���Ȼ����ܵ��� | D�� | �Ȼ��Ʋ��ֽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ���缫����������Ӧ | |
| B�� | �Ҳ����ɵ�������ʹʪ��ĵ��۵⻯����ֽ���� | |
| C�� | ���һ��ʱ���B���ų�NaOH��Һ | |
| D�� | ��ⱥ��ʳ��ˮ�����ӷ���ʽ��2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$2OH-+H2��+Cl2�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com