
| A、熔点:CO2>KCl>SiO2 |
| B、结合质子能力:Cl->CH3COO->OH- |
| C、沸点:乙烷>戊烷>丁烷 |
| D、热稳定性:HF>H2O>NH3 |


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
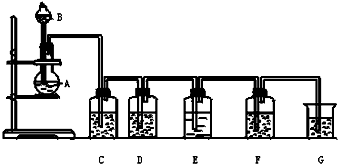 实验室用如图所示装置制备氯气(加热装置略去),并进行氯气性质实验,请回答下列问题:
实验室用如图所示装置制备氯气(加热装置略去),并进行氯气性质实验,请回答下列问题:| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量1mol/L稀盐酸于试管A中,加入少量MnO2,再加入 | |
| 步骤2:取少量1mol/L稀盐酸于试管B中,加入少量MnO2,再加入 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2是还原产物 |
| B、HCl全部被还原 |
| C、KMnO4被氧化 |
| D、HCl既表现还原性又表现酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤正确 | B、都不正确 |
| C、③④正确 | D、仅⑤正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 正极 | Zn | Cu | Cu | Fe |
| 负极 | Cu | Zn | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | HCl |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同质量、不同密度的N2和CO |
| B、同温度、同体积的H2和N2 |
| C、同体积、同密度的N2O和CO2气体 |
| D、同压强、同体积的N2O和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH |
| B、Zn |
| C、Fe |
| D、NH3?H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com