
����Ŀ��ijͬѧ��ͭ��Ũ���ᷴӦ�����ĺ�ɫ��������̽����ʵ�鲽�����£�
������ͭ˿����Ũ���ᣬ���ȣ�
������������ɫ����������ʱ�����ͭ˿��ֹͣ���ȣ�
����ȴ�ӷ�Ӧ��Ļ�����з������ɫ������ϴ�������ﱸ�ã�
��1������������������ ��
��2��������У����ӷ�Ӧ��Ļ�����з������ɫ�������IJ����� ��
��3����ͬѧ�����ɫ������CuO������������£�
�������ף�������Cu2+�ķ����ǣ�����Һ�еμ�K4[Fe��CN��6]��Һ�����������ɫ������֤����Cu2+ ��
�ٽ�CuO����ϡ�����У�һ��ʱ������������ٵμ�K4[Fe��CN��6]��Һ���������ɫ������
�ڽ���ɫ��������ϡ�����У�һ��ʱ��μ�K4[Fe��CN��6]��Һ��δ�����ɫ������
�ɸü���������ý����� ��
��4���ٴμ��裬��ɫ������ͭ�����ʵ�����£�
ʵ��װ�� | ���� |
| 1A�Թ��к�ɫ�������ܽ� |
������2˵����ɫ���������ԣ�
�ڲ�������ɫ����Ļ�ѧ����ʽ�� ��
����ȷ�Ϻ�ɫ�����к���SԪ�ص������� �� ��Ӧ�����ӷ���ʽ�� ��
��Ϊȷ�Ϻ�ɫ�����ǡ�ͭ�������������е�ʵ���� ��
��5������ʵ��˵������ɫ�����д���ͭ�������һ��ʵ���֤����ɫ������CuS��Cu2S�Ļ�������ɫ��������Ũ�����м���һ��ʱ�������ȫ�ܽ⣬����CuS�ܽ�Ļ�ѧ����ʽ�� ��
���𰸡�
��1��SO2
��2������Ӧ��Ļ���ﵹ��װ����ˮ���ձ��У���ȴ�����
��3����ɫ�����в�����CuO
��4����ԭ��2NO+O2�T2NO2��B�Թ��г��ְ�ɫ������NO2+SO2+Ba2++H2O�TBaSO4��+NO��+2H+��ȡ��ȴ��Aװ���Թ��е���Һ���μ�K4[Fe��CN��6]��Һ�����������ɫ������֤����Cu2+ �� ˵����ɫ������ͭ������
��5��CuS+4H2SO4��Ũ�� ![]() CuSO4+4SO2��+4H2O
CuSO4+4SO2��+4H2O
���������⣺��1��Cu��Ũ���ᷴӦ��������ͭ�����������ˮ����ӦΪCu+2H2SO4��Ũ�� ![]() CuSO4+2SO2��+2H2O������������������SO2 �� ���Դ��ǣ�SO2����2��������У����ӷ�Ӧ��Ļ�����з������ɫ�������IJ���Ϊ������Ӧ��Ļ���ﵹ��װ����ˮ���ձ��У���ȴ����ˣ�
CuSO4+2SO2��+2H2O������������������SO2 �� ���Դ��ǣ�SO2����2��������У����ӷ�Ӧ��Ļ�����з������ɫ�������IJ���Ϊ������Ӧ��Ļ���ﵹ��װ����ˮ���ձ��У���ȴ����ˣ�
���Դ��ǣ�����Ӧ��Ļ���ﵹ��װ����ˮ���ձ��У���ȴ����ˣ���3������Һ�еμ�K4[Fe��CN��6]��Һ�����������ɫ������֤����Cu2+ �� ���ݢڽ���ɫ��������ϡ�����У�һ��ʱ��μ�K4[Fe��CN��6]��Һ��δ�����ɫ������֪����ɫ������һ������CuO��
���Դ��ǣ���ɫ�����в�����CuO����4����A�Թ����Ϸ����ֺ���ɫ���壬˵����Ӧ����һ���������ɣ�֤���˺�ɫ������л�ԭ�ԣ��ڷ�Ӧ�б�������
���Դ��ǣ���ԭ���ں���ɫ����Ϊ������������Ӧ�Ļ�ѧ����ʽΪ��2NO+O2�T2NO2 ��
���Դ��ǣ�2NO+O2�T2NO2���۸��ݷ�Ӧ�����B�Թ��г��ְ�ɫ������֪����ɫ����Ϊ���ᱵ��˵����ɫ�����к�����Ԫ�أ�������Ӧ�����ӷ���ʽΪ��NO2+SO2+Ba2++H2O�TBaSO4��+NO��+2H+ ��
���Դ��ǣ�B�Թ��г��ְ�ɫ������NO2+SO2+Ba2++H2O�TBaSO4��+NO��+2H+����Ϊȷ�Ϻ�ɫ�����ǡ�ͭ���������������ɫ�����к���ͭ���ӣ�����Ϊ��ȡ��ȴ��Aװ���Թ��е���Һ���μ�K4[Fe��CN��6]��Һ�����������ɫ������֤����Cu2+ �� ˵����ɫ������ͭ�����
���Դ��ǣ�ȡ��ȴ��Aװ���Թ��е���Һ���μ�K4[Fe��CN��6]��Һ�����������ɫ������֤����Cu2+ �� ˵����ɫ������ͭ�������5��Ũ�������ǿ�����ԣ���ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽΪ��CuS+4H2SO4��Ũ�� ![]() CuSO4+4SO2��+4H2O��
CuSO4+4SO2��+4H2O��
���Դ��ǣ�CuS+4H2SO4��Ũ�� ![]() CuSO4+4SO2��+4H2O��
CuSO4+4SO2��+4H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�������
A.�ڽӴ�������98.3%��Ũ��������SO3 �� Ŀ���Ƿ�ֹ�γ���������SO3������ȫ
B.��ҵ�Ʋ��������������ж�Ҫ����ʯ��ʯ��Ŀ���dz�ȥ���ʶ�������
C.��ҵ���ý�������TiCl4��Һ�ڸ����·�Ӧ��Ŀ���ǽ������Ѵ��Ȼ������û�����
D.��ˮ����ȡþ�Ĺ����м��뱴�������Ƶõ�ʯ�ң�Ŀ���ǽ�Mg2+ת���Mg��OH��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������30mLͬһŨ�ȵ�NaOH��Һ��ͨ��CO2���壬��CO2ͨ�����IJ�ͬ����Һ�����Ҳ��ͬ���õ���ҺM��N������M��N��Һ����μ���Ũ��Ϊ0.25molL��1���ᣬ�������������v��CO2���������������v��HCl���Ĺ�ϵ�ֱ�Ϊ��ͼ��ʾ�������A��B��
��ش��������⣺
��1��NaOH��Һ�����ʵ���Ũ��Ϊ ��
��2��M��N����Һ����ͬ������ʵ����ʵ���֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ش�
��1�������������ʽ��ʾ���[NaAl��SiO3��2]����� ��
��2��þȼ�ղ�����CO2����û�ѧ����ʽ��ʾ������ ��
��3����NaHSO4��Һ�еμ�Ba��OH2����Һ����Һ�����ԣ��÷�Ӧ�����ӷ���ʽ ��
��4��д�����з�Ӧ�Ļ�ѧ����ʽ�� �����ջ�����FeS2����
����֪��������Cl2��Br2��Fe3+ �� д��FeBr2��Һ������ʵ���Cl2��Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ��ȤС��Ϊ�о����������ʣ������ͼ��ʾװ�ý���ʵ�飬װ�â��мг�װ������ȥ������aΪ�����Ʒ����ֽ��bΪʪ���Ʒ����ֽ�� 
��1�������X������ ��
��2������ҩƷǰ�����������巢��װ�������ԵIJ����ǣ���ֹˮ�м�סC�� ��
��3��д��װ�â��з�����Ӧ�����ӷ���ʽ ��
��4��ʵ������У�װ�â��е�ʵ������Ϊ ��
��5��ʵ������У�����ͬѧ��װ�â��й۲쵽b�ĺ�ɫ��ȥ�����Dz�δ�۲쵽��a�����Ա仯����һԤ�������ԭ���� �� Ϊ�ﵽԤ������Ӧ��θĽ�װ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A�Ƿ���ʽΪC7H8�ķ���������֪����������һϵ��ת����ϵ������C��һ��һԪ����D��A�Ķ�λһȡ���H��E��I��F�ֱ�Ϊͬ���칹�壺
��1��������I�Ľṹ��ʽ�� ��
��ӦB��C�Ļ�ѧ����ʽ��.
��2�����ʵ��֤��H�к�����ԭ�ӣ������õ����Լ���.
��3��Ϊ��֤E��F�ķ�Ӧ������E��G��ͬ������ʵ�鷽����ʵ���е���_____________��
A.��E��F��Ӧ��Ļ��Һ�м��������ữ���ټ���AgNO3��Һ�õ�����ɫ����
B.��E��F��Ӧ��Ļ��Һ�м�����ˮ��������ˮ������ɫ
C.��E��F��Ӧ��Ļ��Һ�м��������ữ�������CCl4��Һ��ʹ֮��ɫ
D.��E��F��Ӧ��Ļ��Һ�м�������KMnO4��Һ�����Һ��ɫ��dz
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к��зḻ�ĵ�Ԫ�أ���ʵ�����У����ǿ����ú���ͨ���ಽʵ���Ƴɵ�ˮ������˵����ȷ���ǣ�������
A.��ʵ�������Ҫ�õ�������
B.����ⵥ���Ƿ���ڣ����õ⻯����Һ
C.Ҫ��ȡ��ˮ�еĵ⣬���������ͻ�ƾ�
D.������ͼ��ʾװ�ò��ܷ���ʳ�κ;����Ļ����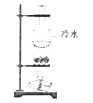
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��E��F��G��Ԫ�ص�ԭ����������������ԭ�ӵĺ�������������Ų���Ϊ4s1 ��
��EԪ����ɵĵ��ʵľ���ѻ�ģ��Ϊ���������ѻ���һ�������о�̯��Eԭ�ӣ�Eԭ�ӵ���λ��Ϊ
��FԪ�����仯����������ϼ�Ϊ ��
��G2+���ӵĺ�����Ӽ����Ų�ʽΪ �� G2+���ӵĺ�����������˶�״̬�������ܼ���G2+���ӵĺ������ռ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ���������ȷ����
A. ����ˮ������Ƶ�������
B. ��ƿ�ʹϸ�������������ʱ��Զ�����
C. �����������Ի�����������Ӧ������
D. ��֬�����ܷ����ӳɷ�Ӧ��������һ�������·���ˮ�ⷴӦ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com