解:(1)①设1m
3尾气中NO
2的物质的量为x,则NO的物质的量为4x,4xmol×30g/mol+46xg=2.49g,x=0.015mol,所以1m
3尾气中NO
2的物质的量为0.015mol,则NO的物质的量为0.06mol,
根据4NO+4NH
3+O
2
4N
2+6H
2O 知,0.06molNO需要0.06molNH
3,0.015molO
2,根据方程式 6NO
2+8NH
3
7N
2+12H
2O知,0.015molNO
2需要0.02molNH
3,所以氨氧混合气体的平均摩尔质量
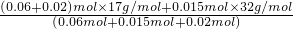
=19.37g/mol,所以其相对分子质量为19.37,
故答案为:19.37;
②1m
3尾气中NO的物质的量为0.06mol,所以其m=nM=0.06mol×30g/mol=1800mg,故答案为:1800;
③处理1m
3尾气需要氨氧混合物的体积=(0.06+0.02+0.015)mol×22.4L/mol=2.128L,则要处理5m
3的尾气,需要氨氧混合气的体积为=2.128L×5=10.64L,故答案为:10.64L;
(2)①C=

=
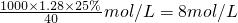
,根据原子守恒知,氮氧化物的物质的量等于氢氧化钠的物质的量,所以V=

=
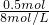
=62.5mL,故答案为:8,62.5;
②2NO
2+2NaOH=NaNO
2+NaNO
3+H
2O和NO+NO
2+2NaOH=2NaNO
2+H
2O,根据氮原子守恒知,生成0.35mol亚硝酸钠则生成0.15mol硝酸钠,生成0.15mol硝酸钠需要0.3mol二氧化氮,同时生成0.15mol亚硝酸钠,0.2mol亚硝酸钠需要0.1mol一氧化氮,所以二氧化氮的物质的量是0.4mol,根据氧原子守恒得x=
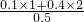
=1.8,
故答案为:1.8;
(3)设每小时生产石膏的质量为mg,生成硫酸钙的质量为X,可中和硫酸工业废水的质量为Y、需要
石灰乳的质量为Z,
CaSO
4+2H
2O=CaSO
4?2H
2O
136 172
X mg
X=
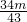
g
H
2SO
4+Ca(OH)
2=CaSO
4+2H
2O
98 74 136
4.9%Y 22.2%Z
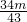
g
Y=11.63mg
Z=1.94mg
则根据质量守恒定律得:Y+Z=m+276.5t
11.63m+1.94g/m=m+276.5t
m=22t,
答:每小时生产石膏的质量22吨.
分析:(1)①先根据尾气中二氧化氮和一氧化氮的关系计算二氧化氮、一氧化氮的物质的量,再根据方程式计算氨气和氧气的物质的量,最后根据M=

计算其平均相对分子质量;
②根据m=nM计算;
③根据V=nV
m计算需要氨氧混合气体的体积;
(2)①C=

,根据原子守恒知,氮氧化物的物质的量等于氢氧化钠的物质的量,再根据V=

计算;
②根据方程式2NO
2+2NaOH=NaNO
2+NaNO
3+H
2O和NO+NO
2+2NaOH=2NaNO
2+H
2O中氮原子守恒计算NO和NO2的物质的量分别是多少,根据氧原子守恒解答;
(3)根据质量守恒进行解答,即废水的质量和石灰乳的质量之和等于达标废水的质量和石膏质量之和.
点评:本题考查含氮物质的有关计算,根据原子守恒、质量守恒结合方程式来分析解答,计算量较大,难度中等.

 4N2+6H2O 6NO2+8NH3
4N2+6H2O 6NO2+8NH3 7N2+12H2O
7N2+12H2O 4N2+6H2O 知,0.06molNO需要0.06molNH3,0.015molO2,根据方程式 6NO2+8NH3
4N2+6H2O 知,0.06molNO需要0.06molNH3,0.015molO2,根据方程式 6NO2+8NH3 7N2+12H2O知,0.015molNO2需要0.02molNH3,所以氨氧混合气体的平均摩尔质量
7N2+12H2O知,0.015molNO2需要0.02molNH3,所以氨氧混合气体的平均摩尔质量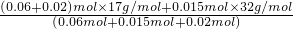 =19.37g/mol,所以其相对分子质量为19.37,
=19.37g/mol,所以其相对分子质量为19.37, =
=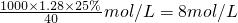 ,根据原子守恒知,氮氧化物的物质的量等于氢氧化钠的物质的量,所以V=
,根据原子守恒知,氮氧化物的物质的量等于氢氧化钠的物质的量,所以V= =
=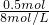 =62.5mL,故答案为:8,62.5;
=62.5mL,故答案为:8,62.5; 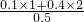 =1.8,
=1.8,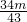 g
g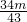 g
g 计算其平均相对分子质量;
计算其平均相对分子质量; ,根据原子守恒知,氮氧化物的物质的量等于氢氧化钠的物质的量,再根据V=
,根据原子守恒知,氮氧化物的物质的量等于氢氧化钠的物质的量,再根据V= 计算;
计算;

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案