
| A. | 3.6g | B. | 1.8g | C. | 7.2g | D. | 4.8g |
分析 碱石灰吸收二氧化碳与水,剩余2.8g为CO的质量,可以计算二氧化碳与水的总质量,由甲烷分子式可知C、H原子数目之比为1:4,根据原子守恒可知2n(CO)+2n(CO2)=n(H2O),联立计算.
解答 解:碱石灰吸收二氧化碳与水,剩余2.8g为CO的质量,则二氧化碳与水的总质量=14.4g-2.8g=11.6g,
由甲烷分子式可知C、H原子数目之比为1:4,根据原子守恒可知2n(CO)+2n(CO2)=n(H2O),
CO的物质的量为$\frac{2.8g}{28g/mol}$=0.1mol,
设二氧化碳为xmol、水蒸气为ymol,则:
$\left\{\begin{array}{l}{44x+18y=11.6}\\{0.1×2+2x=y}\end{array}\right.$
解得x=0.1,y=0.4,
故水蒸气的质量为0.4mol×18g/mol=7.2g
故选:C.
点评 本题考查混合物有关计算,关键是根据甲烷分子式确定水蒸气物质的量与一氧化碳、二氧化碳总的物质的量关系.


科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ②③⑤⑥ | C. | ②④⑤⑥ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,22.4 L NH3中含有共价键的数目为3NA | |
| B. | 50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 标准状况下,11.2 L CCl4所含的分子数目为0.5NA | |
| D. | 若由CO2和O2组成的混合物中共有NA个分子,则其中的氧原子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10:7:11 | B. | 11:11:8 | C. | 11:10:8 | D. | 10:11:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
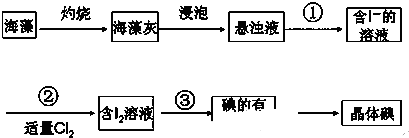
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:
某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:| 实验序号 | 待测液体积(ML) | 所消耗NaOH标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.50 |
| 2 | 20.00 | 6.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
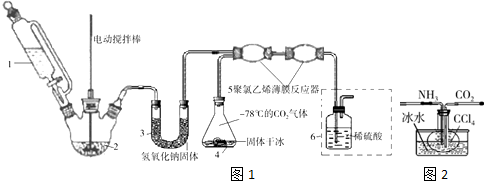
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
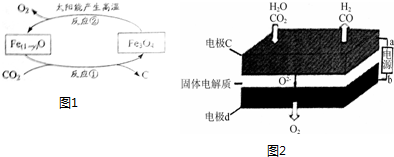
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com