
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ||||||||||||||
| ⑥ | ⑦ | ⑧ | |||||||||||||||
| ⑨ | ⑩ |

分析 根据元素在周期表中的位置可知:①为H,②为Mg,③为C,④为N,⑤为O,⑥为Na,⑦为Al,⑧为Cl,⑨为Fe,⑩为Cu,
(1)H、C形成的6原子气态化合物为C2H4;
(2)元素⑨为Fe,其各层的电子数为2、8、14、2,Al与Fe2O3在高温下反应生成Fe和氧化铝;
(3)N元素2p能级是半满稳定状态,不易失电子;设A的化学式为NxOy,N、O的质量比为7:12,结合相对分子质量确定化学式;
(4)⑥为Na,⑧为Cl,可形成某离子化合物NaCl,Cl-处于面心和顶点,Na+处于棱上;X处于面心和顶点,属于ABCABC的堆积方式;
(5)图2属于面心立方最密堆积,根据均摊法结合原子所处的位置计算原子数.
解答 解:根据元素在周期表中的位置可知:①为H,②为Mg,③为C,④为N,⑤为O,⑥为Na,⑦为Al,⑧为Cl,⑨为Fe,⑩为Cu,
(1)H、C形成的6原子气态化合物为C2H4,其分子中含有4个C-H和1个C=C,则含 5个σ键,1个π键;
故答案为:5;1;
(2)元素⑨为Fe,其各层的电子数为2、8、14、2,则Fe的次外层含有14个电子;Al与Fe2O3在高温下反应生成Fe和氧化铝,其反应的方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
故答案为:14;2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(3)N元素2p能级是半满稳定状态,能量较低,不易失电子,第一电离能高于同周期相邻元素,故第一电离能N>O;
设A的化学式为NxOy,N、O的质量比为7:12,则$\frac{14x}{16y}$=$\frac{7}{12}$,所以$\frac{x}{y}$=$\frac{2}{3}$,已知相对分子质量为152,所以A的化学式为N4O6;
故答案为:N;N4O6;
(4)⑥为Na,⑧为Cl,可形成某离子化合物NaCl,Cl-处于面心和顶点,Na+处于棱上,则图1中部分棱上没有离子,所以不能代表NaCl的晶胞结构;X处于面心和顶点,属于ABCABC的堆积方式;
故答案为:不能;ABCABC;
(5)图2属于面心立方最密堆积,该晶胞中金属原子的配位数为12;晶胞中原子处于顶点和面心上,则每个晶胞“实际”拥有的原子数是6×$\frac{1}{2}$+8×$\frac{1}{8}$=4;
故答案为:12;4.
点评 本题考查了元素周期表、电子排布规律、配位数的判断、晶胞结构图的分析和判断等,题目难度中等,注意把握晶胞中该原子的配位数计算方法,熟悉常见的晶体堆积方式.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:解答题
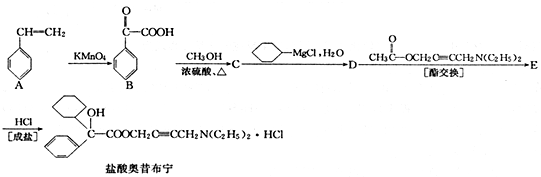
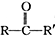 +
+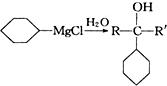 请回答下列问题
请回答下列问题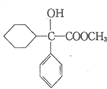 .
.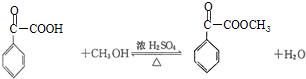 ,属取代反应.
,属取代反应.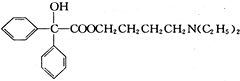 互为同分异构体
互为同分异构体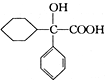 可发生缩聚反应.
可发生缩聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入MnCO3的目的是除去Fe3+ | |
| B. | 常温下,pH=4时,Fe3+已除尽 | |
| C. | 反应Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)的K=1.35×1022 | |
| D. | Mn2(OH)2CO3、Mn(OH)2都可以替代MnCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
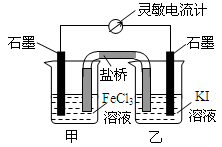
| A. | 反应开始时,甲池中电极反应为Fe3++e-=Fe2+ | |
| B. | 反应开始时,盐桥中的阴离子向乙池迁移 | |
| C. | 反应处于化学平衡状态时,甲、乙两池中离子浓度不再变化 | |
| D. | 反应处于化学平衡状态时,电子沿着石墨(乙池)→电流计→石墨(甲池)路径流动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol•L-1 | B. | 0.1 mol•L-1 | C. | 0.5 mol•L-1 | D. | 1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 柴油、汽油、牛油、植物油等属于烃类物质 | |
| B. | 含五个碳原子的有机物,分子中最多可形成四个碳碳单键 | |
| C. |  是某有机物与H2发生加成反应后的产物.符合该条件的稳定有机物共有3种 是某有机物与H2发生加成反应后的产物.符合该条件的稳定有机物共有3种 | |
| D. | 结构片段为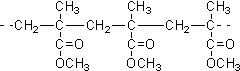 的高聚物,是其单体通过缩聚反应生成 的高聚物,是其单体通过缩聚反应生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com