
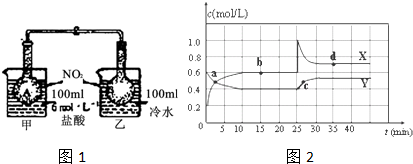
| 0.2mol/L |
| 10min |
| 0.62 |
| 0.4 |


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
| A、碳酸钙与稀盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、氧化铜与稀硫酸反应:CuO+2H+=Cu2++H2O |
| C、氢氧化钡和硫酸溶液反应:OH-+H+=H2O |
| D、铝与稀硫酸反应:Al+2H+=Al3++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | O | ||||||||||||||||

查看答案和解析>>
科目:高中化学 来源: 题型:
 某小组进行铝热反应实验,装置如图所示.
某小组进行铝热反应实验,装置如图所示.| 实 验 步 骤 | 现 象 | 结 论 |
| ①取少量黑色固体于试管中加稀盐酸 | 固体全部溶解,有气泡产生 | 假设I成立,假设Ⅱ不成立 |
| ②滴入几滴0.01mol/LKSCN溶液 | 溶液不变色 |
| 实验编号 | 实验步骤 |
| 1 | ①滴加饱和FeCl3溶液4滴,充分振荡 |
| ②滴加几滴NaOH溶液 | |
| 2 | ①滴加4滴1mol/LKSCN溶液 |
| ②滴加几滴NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
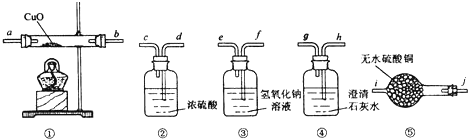
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| KOH |
| 室温 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、近期媒体报道的某白酒中的增塑剂是对人体健康无害的物质 |
| B、尽量使用含12C的产品,减少使用含13C或14C的产品符合“促进低碳经济”的宗旨 |
| C、垃圾是放错地方的资源,应分类回收利用 |
| D、光化学烟雾、酸雨等可能与PM2.5的存在有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com